高中 | 杂化轨道理论 题目答案及解析
稿件来源:高途
高中 | 杂化轨道理论题目答案及解析如下,仅供参考!
选修三
第二章 分子结构与性质
第二节 分子的立体结构
杂化轨道理论
回答下列问题:
过渡金属元素铁能形成多种配合物,如:$\rm [Fe(H_{2}NCONH_{2})_{6}]$ $\rm (NO_{3})_{3}$ $\rm [$三硝酸六尿素合铁$\rm ($Ⅲ$\rm )]$和$\rm Fe(CO)_{x}$等。
①基态$\rm Fe^{3+}$的$\rm M$层电子排布式为 。
②配合物$\rm Fe(CO)_{x}$的中心原子价电子数与配体提供电子数之和为$\rm 18$,则$\rm x=$ 。 $\rm Fe(CO)_{x}$常温下呈液态,熔点为$\rm -20.5\;\rm ^\circ\rm C$,沸点为$\rm 103\;\rm ^\circ\rm C$,易溶于非极性溶剂,据此可判断$\rm Fe(CO)_{x}$晶体属于 (填晶体类型);
$\\rm 3s^{2}3p^{6}3d^{5}$ $\\rm 5$ 分子晶体
"]]①基态$\rm Fe^{3+}$的$\rm M$层电子排布式为:$\rm 3s^{2}3p^{6}3d^{5}$
②配合物$\rm Fe(CO)_{x}$的中心原子是铁原子,其价电子数是$\rm 8$,(价电子就是元素周期表中每种元素下边的那个表示形式中的电子之和)每个配体提供的电子数是$\rm 2$,$\rm 8+2x=18$,$\rm x=5$,分子晶体的熔沸点较低,根据题给信息知,该物质的熔沸点较低,所以为分子晶体,故答案为$\rm 5$;分子晶体。
$\rm O$和$\rm Na$形成的一种只含有离子键的离子化合物的晶胞结构如右图,距一个阴离子周围最近的所有阳离子为顶点构成的几何体为 。已知该晶胞的密度为$\rm \rho$ $\rm g/cm^{3}$,阿伏加德罗常数为$\rm N_{A}$,求晶胞边长 $a$ $\rm =$ $\rm \;\rm cm$。 $\rm ($用含$\rm \rho$、$\rm N_{A}$的计算式表示$\rm )$
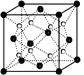
立方体 $\\sqrt[3]{\\dfrac{248}{\\rho \\cdot N_{A}}}cm$
"]]由$\rm Na_{2}O$晶胞结构结构可知,晶胞中黑色球数目$\rm =8\times $ $\dfrac{1}{8}$ $\rm +6\times $ $\dfrac{1}{2}\rm =4$,白色球数目$\rm =8$,故白色球为$\rm Na^{+}$离子、黑色球为$\rm O^{2-}$,以晶胞中上面心$\rm O^{2-}$离子为研究对象,距一个$\rm O^{2-}$周围最近的$\rm Na^{+}$离子有$\rm 8$个,位于晶胞中上层$\rm 4$个$\rm Na^{+}$及上面晶胞中的下层$\rm 4$个$\rm Na^{+}$,$\rm 8$个$\rm Na^{+}$离子构成的几何体中每个都是正方形,形成立方体结构;
该晶胞质量$\rm =4\times \dfrac{62}{N_{A}}\rm g$,该晶胞的密度为$\rm \rho$ $\rm g\cdot cm^{-3}$,则晶胞边长$\rm a=\sqrt[3]{\dfrac{4 \times \dfrac{62}{N_{A}}g}{\rho g/cm}} = \sqrt[3]{\dfrac{248}{\rho \cdot N_{A}}}cm$
故答案为立方体结构;$\sqrt[3]{\dfrac{248}{\rho \cdot N_{A}}}cm$
下列有关的说法正确的是$(\quad\ \ \ \ )$。
第一电离能大小:$\\rm S\\gt P\\gt Si$
","电负性顺序:$\\rm C\\lt N\\lt O\\lt F$
","因为晶格能$\\rm CaO$比$\\rm KCl$高,所以$\\rm KCl$比$\\rm CaO$熔点低
","$\\rm SO_{2}$与$\\rm CO_{2}$的化学性质类似,分子结构也都呈直线型,相同条件下$\\rm SO_{2}$的溶解度更大
","分子晶体中,共价键键能越大,该分子晶体的熔沸点越高
"]$\rm BC$
原子序数小于$\rm 36$的$\rm X$、$\rm Y$、$\rm Z$、$\rm W$四种元素,其中$\rm X$是形成化合物种类最多的元素,$\rm Y$原子基态时最外层电子数是其内层电子数的$\rm 2$倍,$\rm Z$原子基态时$\rm 2p$原子轨道上有$\rm 3$个未成对的电子,$\rm W$的原子序数为$\rm 29$。回答下列问题:
① $\rm Y_{2}X_{2}$分子中$\rm Y$原子轨道的杂化类型为 ,$\rm 1\;\rm mol$ $\rm Y_{2}X_{2}$含有$\rm \sigma$键的数目为 。
② 化合物$\rm ZX_{3}$的沸点比化合物$\rm YX_{4}$的高,其主要原因是 。
③ 元素$\rm Y$的一种氧化物与元素$\rm Z$的一种氧化物互为等电子体,元素$\rm Z$的这种氧化物的分子式是 。
$\\rm sp$杂化;$\\rm 3$ $\\rm N_{A}$或$\\rm 3\\times 6.02\\times 10^{23}$个 $\\rm NH_{3}$分子存在氢键 $\\rm N_{2}O$
"]]依题意可知$\rm X$、$\rm Y$、$\rm Z$、$\rm W$分别对应的是氢元素、碳元素、氮元素、和铜元素。
①$\rm sp$杂化; $\rm 3$ $\rm N_{A}$或$\rm 3\times 6.02\times 10^{23}$个 ②$\rm NH_{3}$分子存在氢键 ③$\rm N_{2}O$
高中 | 杂化轨道理论题目答案及解析(完整版)
