高中 | 杂化轨道理论 题目答案及解析
稿件来源:高途
高中 | 杂化轨道理论题目答案及解析如下,仅供参考!
选修三
第二章 分子结构与性质
第二节 分子的立体结构
杂化轨道理论
铜及其化合物在日常生产、生活中有着广泛的应用。
将氨水逐滴加入到$\rm CuSO_{4}$溶液中,先产生蓝色沉淀,后沉淀溶解,溶液变为深蓝色。
①写出生成蓝色沉淀的离子方程式 。
②$\rm 1\;\rm mol[Cu(NH_{3})_{4}]^{2+}$离子中含有$\rm \sigma$键 $\rm \;\rm mol$。
③向上述溶液中加入 $\rm ($填试剂$\rm )$并用玻璃棒摩擦试管内壁,则析出深蓝色晶体深蓝色晶体$\rm [Cu(NH_{3})_{4}]SO_{4}·H_{2}O$。
$\\rm CuSO_{4}+2NH_{3}·H_{2}O=Cu(OH)_{2}↓+2NH_{4}^{+}$; $\\rm 16$ ;乙醇
"]]①发生的反应生成蓝色沉淀离子方程式是$\rm CuSO_{4}+2NH_{3}·H_{2}O=Cu(OH)_{2}↓+2NH_{4}^{+}$;
②$\rm 1\;\rm mol[Cu(NH_{3})_{4}]^{2+}$离子中,含有$\rm 4\;\rm mol$配位键,$\rm 1$个$\rm NH_{3}$分子中含有$\rm 3$个共价键,则$\rm 1\;\rm mol[Cu(NH_{3})_{4}]^{2+}$含有$\rm \sigma$键总数为$\rm (4+3\times 4)mol=16\;\rm mol$;
③向上述溶液中加入乙醇,乙醇的极性小于水,在溶液中加入乙醇能够减小溶剂的极性,降低$\rm [Cu(NH_{3})_{4}]SO_{4}$的溶解度,使其析出;
含铜配合物$\rm A$结构如图所示。
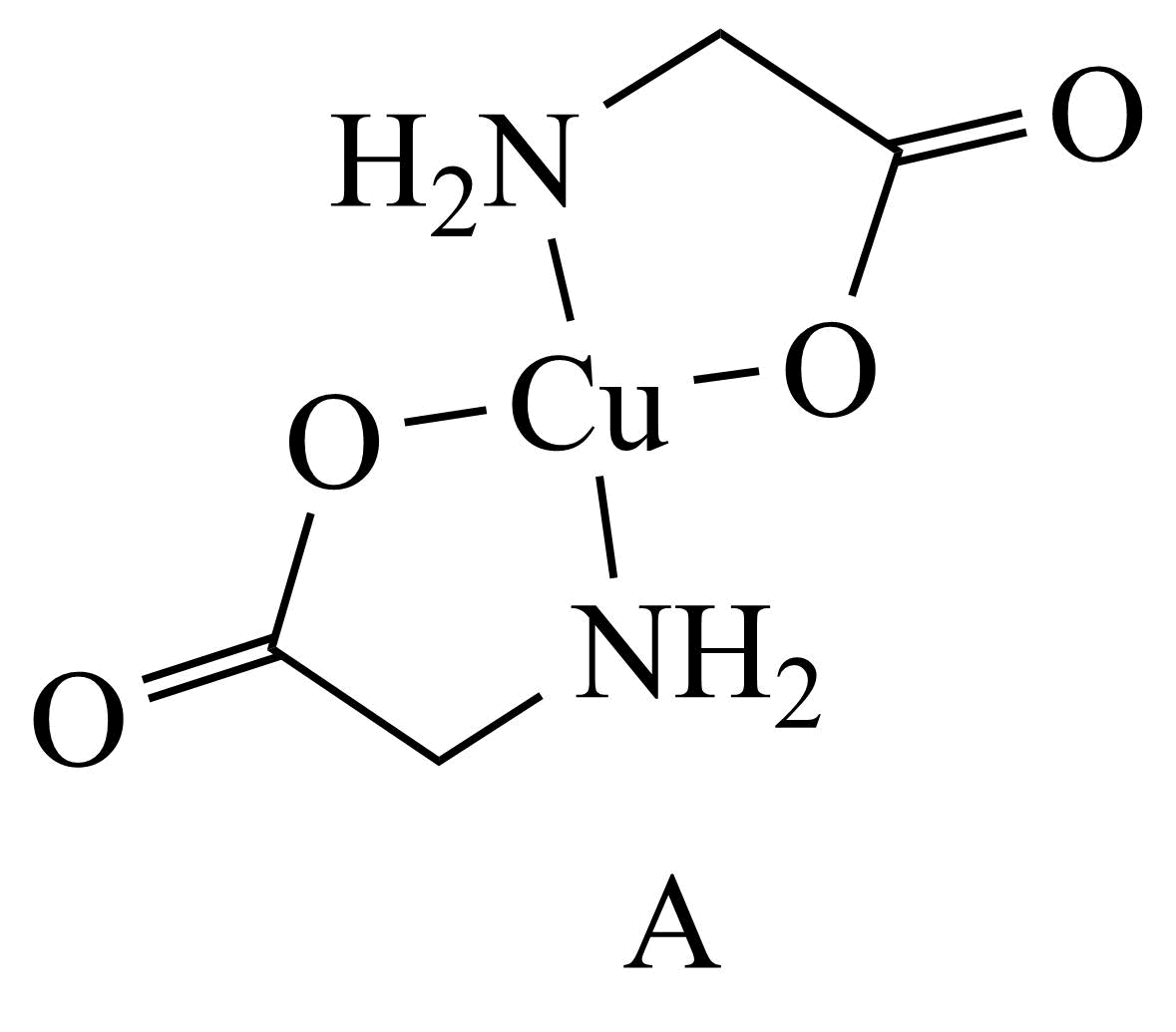
①配合物$\rm A$与足量盐酸反应生成$\rm CuCl_{2}$和 。
②若在配合物$\rm A$中与$\rm Cu$相连的$\rm 4$个配位原子处在一个平面内,则下列$\rm Cu$的杂化方式中正确的是 $\rm ($填标号$\rm )$。
$\rm A$.$\rm sp^{2}$ $\rm B$.$\rm sp^{3}$ $\rm C$.$\rm dsp^{2}$
$\\rm NH_{2}CH_{2}COOH·HCl$或$\\rm ^{+}NH_{3}CH_{2}COOHCl^{﹣}$ $\\rm C$
"]]①配合物$\rm A$与盐酸反应,破坏了配位键,由配合物结构可知,其含有氨基,其与盐酸反应生成了$\rm CuCl_{2}$和$\rm NH_{2}CH_{2}COOH·HCl$或$\rm ^{+}NH_{3}CH_{2}COOHCl^{﹣}$;
②$\rm Cu$的配位数为$\rm 4$,说明不是$\rm sp^{2}$杂化,而$\rm sp^{3}$杂化的原子空间构型应为四面体形,该物质为$\rm 4$个配位原子处在一个平面内,说明不是$\rm sp^{3}$杂化,则应为$\rm dsp^{2}$杂化,故选:$\rm C$;
离子型配合物$\rm [Cu(CH_{3}CN)_{4}]BF_{4}$中,$\rm BF_{4}^{−}$的空间构型为 ,配体中碳原子的杂化方式是 。
正四面体形 $\\rm sp^{3}$、$\\rm sp$
"]]$\rm BF_{4}^{−}$中心原子$\rm B$的价电子对数为$\rm 4+\dfrac{3+1-4 \times 1}{2}=4$,无孤对电子,其空间构型为正四面体形;配体为$\rm CH_{3}CN$,其中$\rm C$与$\rm N$之间为三键,则该碳原子杂化方式为$\rm sp$杂化,甲基上的碳原子为饱和碳原子,其杂化方式为$\rm sp^{3}$;
某$\rm Fe_{x}N_{y}$的晶胞如图$\rm 1$所示,$\rm Cu$可以完全替代该晶体中$\rm a$位置$\rm Fe$或者$\rm b$位置$\rm Fe$,形成$\rm Cu$替代型产物$\rm Fe_{x-n}Cu_{n}N_{y}$。$\rm Fe_{x}N_{y}$转化为两种$\rm Cu$替代型产物的能量变化如图$\rm 2$所示,其中更稳定的$\rm Cu$替代型产物的化学式为 。
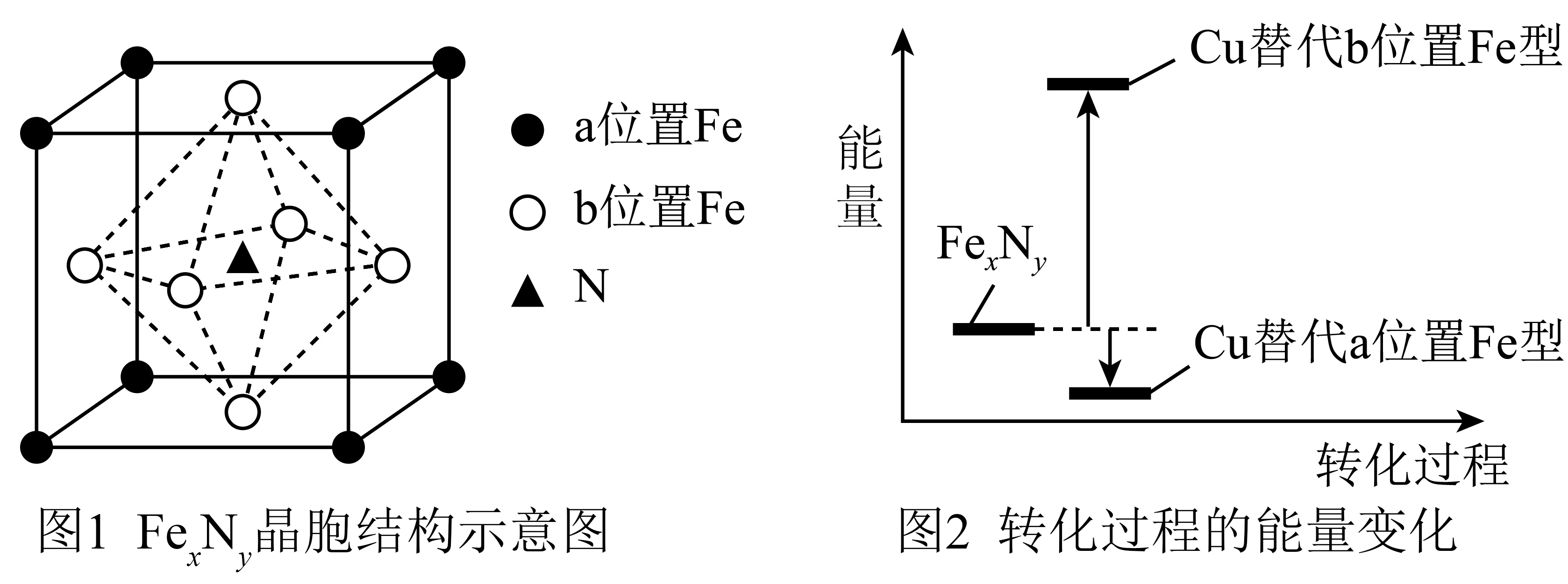
$\\rm Fe_{3}CuN$
"]]能量越低越稳定,由图$\rm 2$可知,$\rm Cu$代替$\rm a$位置$\rm Fe$型晶胞更稳定,其晶胞中$\rm Cu$位于$\rm 8$个顶点,其原子个数为$\rm 8 \times \dfrac{1}{8}=1$,$\rm Fe$位于面心,个数为$\rm 6 \times \dfrac{1}{2}=3$,$\rm N$位于体心,个数为$\rm 1$,则晶胞化学式为$\rm Fe_{3}CuN$;
溴化亚铜$\rm (CuBr)$常用作有机合成原料和反应催化剂,其晶胞结构如图所示。已知①、②号铜原子坐标依次为$\rm (0$,$\rm 0$,$\rm 0)$、$\rm (\dfrac{1}{2}$,$\rm 0$,$\rm \dfrac{1}{2}\rm )$,则③号溴原子的坐标为 ;设$\rm CuBr$的密度为$\rm dg·cm^{-3}$,$\rm M(CuBr)=ag·mol^{-1}$,$\rm N_{A}$为阿伏伽德罗常数,则$\rm Cu$原子与$\rm Br$原子的核间距离为 $\rm \;\rm cm($用含$\rm a$、$\rm d$、$\rm N_{A}$的代数式表示$\rm )$
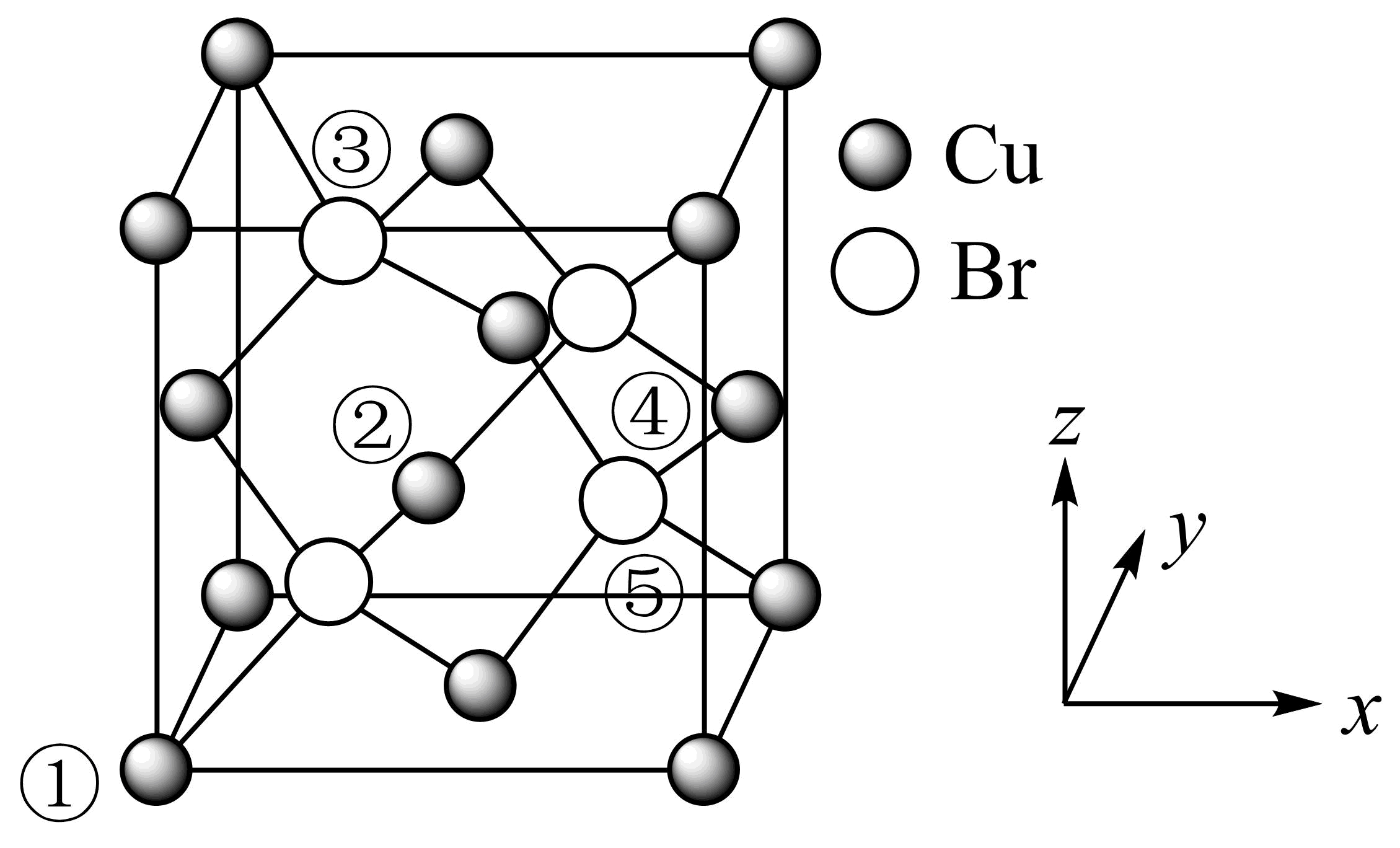
$\\rm (\\dfrac{1}{4}$,$\\rm \\dfrac{3}{4}$,$\\rm \\dfrac{3}{4}\\rm )$ $\\rm \\dfrac{\\sqrt{3}}{4} \\times \\sqrt[3]{\\dfrac{4a}{{dN}_{A}}}$
"]]图中③号溴原子位于上层小正四面体的体心,根据①和②$\rm Cu$原子位置可知,③号坐标参数为$\rm (\dfrac{1}{4}$,$\rm \dfrac{3}{4}$,$\rm \dfrac{3}{4}\rm )$;该晶胞中$\rm Cu$个数$\rm =8 \times \dfrac{1}{8}+6 \times \dfrac{1}{2}=4$,$\rm Br$位于晶胞内部,其个数为$\rm 4$,则晶胞的质量为$\rm \dfrac{4a}{N_{A}}\rm g$,设晶胞边长为$\rm acm$,则晶胞体积为$\rm a^{3}\;\rm cm^{3}=\dfrac{\text{m}}{\rho} = \dfrac{4a}{{dN}_{A}}$,则$\rm a=\sqrt[3]{\dfrac{4a}{{dN}_{A}}}\rm cm$,晶胞$\rm Cu$原子与$\rm Br$原子的核间距离为体对角线的$\rm \dfrac{1}{4}$,即$\rm \dfrac{1}{4} \times \sqrt{3} \times \sqrt[3]{\dfrac{4a}{{dN}_{A}}}\rm =\dfrac{\sqrt{3}}{4} \times \sqrt[3]{\dfrac{4a}{{dN}_{A}}}\rm cm$。
高中 | 杂化轨道理论题目答案及解析(完整版)
