高中 | 杂化轨道理论 题目答案及解析
稿件来源:高途
高中 | 杂化轨道理论题目答案及解析如下,仅供参考!
选修三
第二章 分子结构与性质
第二节 分子的立体结构
杂化轨道理论
氯化亚铜$\rm (CuCl$,$\rm M = 99.5\;\rm g ⋅ mol^{-1}\rm )$可用作催化剂、杀菌剂、媒染剂、脱色剂等。实验室采用氨法浸取制备氯化亚铜以实现废弃物铜电线的有效利用。其制备装置示意图$\rm ($夹持装置等略$\rm )$及步骤如下:
①向烧杯中加入$\rm 13.5\;\rm g\;\rm CuCl_{2}$固体$\rm (0.1\;\rm mol)$,加适量蒸馏水搅拌溶解。然后向所制氯化铜溶液中加氨水,得到深蓝色透明溶液;
②向三颈烧瓶中加入$\rm 7\;\rm g$铜电线$\rm ($过量$\rm )$,磁力搅拌下通过仪器$\rm a$向其中加入①所得溶液,控制温度为$\rm 30$~$\rm 40\;\rm ^\circ\rm C$之间,充分反应至固体不再溶解,冷却至室温后,滤去不溶固体;
③向所得滤液中缓慢滴入盐酸至溶液呈弱酸性,过滤得到$\rm CuCl$固体;
④依次用稀盐酸、乙醇洗涤$\rm CuCl$固体,真空干燥后称重,得产品$\rm 19.0\;\rm g$。
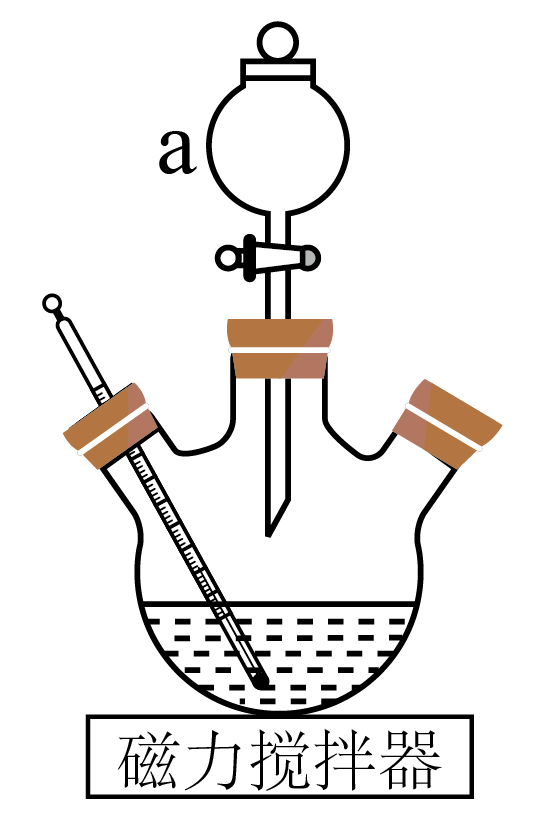
回答下列问题:
铜原子的价层电子排布式为 ;仪器$\rm a$的名称为 。
$\\rm 3d^{10}4s^{1}$ 分液漏斗
"]]铜元素位于元素周期表第四周期第Ⅰ$\rm B$族,铜原子的价层电子排布式为$\rm 3d^{10}4s^{1}$;根据题目所给示意图,仪器$\rm a$的名称为分液漏斗;
步骤①中深蓝色溶液的成分为 $\rm ($填化学式$\rm )$,已知其阳离子的空间构型是平面正方形,则其中心离子的杂化方式为 。
$\rm A$.$\rm sp^{3}$ $\rm B$.$\rm dsp^{2}$ $\rm C$.$\rm d^{2}sp^{3}$ $\rm D$.$\rm sp^{3}d^{2}$
$\\rm [Cu(NH_{3})_{4}]Cl_{2}$ $\\rm B$
"]]步骤①中向氯化铜溶液中滴加氨水先生成氢氧化铜沉淀,继续滴加氨水沉淀溶解,生成深蓝色溶液,深蓝色溶液的成分为$\rm [Cu(NH_{3})_{4}]Cl_{2}$;阳离子$\rm [Cu(NH_{3})_{4}]^{2+}$的空间构型是平面正方形,可知中心离子有$\rm 4$个杂化轨道,因$\rm sp^{3}$杂化为四面体形,则其中心离子的杂化方式应该为$\rm dsp^{2}$;
步骤②中滤液的成分为$\rm [Cu(NH_{3})_{2}]Cl$,该步骤发生反应的化学方程式为 。
$\\rm [Cu(NH_{3})_{4}]Cl_{2} + Cu = 2[Cu(NH_{3})_{2}]Cl$
"]]步骤②中,$\rm [Cu(NH_{3})_{4}]Cl_{2}$与铜单质发生氧化还原反应形成$\rm [Cu(NH_{3})_{2}]Cl$,化学方程式为$\rm [Cu(NH_{3})_{4}]Cl_{2} + Cu = 2[Cu(NH_{3})_{2}]Cl$;
步骤③中加入盐酸时发生的离子方程式为 。
$\\rm [Cu(NH_{3})_{2}]^{+} + 2H^{+} + Cl^{−} = CuCl↓ + 2NH_{4}^{+}$
"]]步骤③加入盐酸的目的是中和$\rm NH_{3}$,发生的离子方程式为$\rm [Cu(NH_{3})_{2}]^{+} + 2H^{+} + Cl^{−} = CuCl↓ + 2NH_{4}^{+}$;
用乙醇洗涤的优点是 ;真空干燥的目的为 。
减少溶解损失,便于固体干燥 防止干燥过程中$\\rm CuCl$被空气中的$\\rm O_{2}$氧化
"]]用乙醇洗涤固体的优点是减少溶解损失,便于固体干燥;$\rm CuCl$有还原性,真空干燥的目的是防止干燥过程中$\rm CuCl$被空气中的$\rm O_{2}$氧化;
本实验中$\rm CuCl$的产率为 $\rm ($结果保留$\rm 3$位有效数字$\rm )$。
$\\rm 95.5\\%$
"]]原料$\rm CuCl_{2}$的物质的量为$\rm 0.1\;\rm mol$,$\rm CuCl$的理论产量是$\rm 0.2\;\rm mol$,即$\rm 19.9\;\rm g$,产率为$\rm \dfrac{19.0\;\rm g}{19.9\;\rm g} \times 100\% = 95.5\%$。
高中 | 杂化轨道理论题目答案及解析(完整版)
