高中 | 配合物理论 题目答案及解析
稿件来源:高途
高中 | 配合物理论题目答案及解析如下,仅供参考!
选修三
第二章 分子结构与性质
第二节 分子的立体结构
配合物理论
在“碳达峰”、“碳中和”的国家战略下,工业生产废气和汽车尾气中的$\text{N}{{\text{O}}_{x}}$和$\text{CO}$的减排及有效处理,显得尤为重要。
在汽车上安装三元催化转化器可实现反应:$2\text{NO}\left( \text{g} \right)+2\text{CO}\left( \text{g} \right) \rightleftharpoons {{\text{N}}_{2}}\left( \text{g} \right)+2\text{C}{{\text{O}}_{2}}\left( \text{g} \right)\qquad\Delta H$。
已知:$2\text{NO}\left( \text{g} \right)+{{\text{O}}_{2}}\left( \text{g} \right)=2\text{N}{{\text{O}}_{2}}\left( \text{g} \right)\qquad\Delta {{H}_{1}}=-144\;\rm \text{kJ}\cdot \text{mo}{{\text{l}}^{-1}}$;
$2\text{CO}\left( \text{g} \right)+{{\text{O}}_{2}}\left( \text{g} \right)=2\text{C}{{\text{O}}_{2}}\left( \text{g} \right)\qquad\Delta {{H}_{2}}=-566\;\rm \text{kJ}\cdot \text{mo}{{\text{l}}^{-1}}$
${{\text{N}}_{2}}\left( \text{g} \right)+2{{\text{O}}_{2}}\left( \text{g} \right)=2\text{N}{{\text{O}}_{2}}\left( \text{g} \right)\qquad\Delta {{H}_{3}}=-66\;\rm \text{kJ}\cdot \text{mo}{{\text{l}}^{-1}}$。
则$\Delta H=$ ,该反应在 $\rm ($填“高温”“低温”或“任何温度”$\rm )$下能自发进行。
$-644\\;\\rm \\text{kJ}\\cdot \\text{mo}{{\\text{l}}^{-1}}$;低温
"]]$2\text{NO}\left( \text{g} \right)+{{\text{O}}_{2}}\left( \text{g} \right)=2\text{N}{{\text{O}}_{2}}\left( \text{g} \right)$①,$2\text{CO}\left( \text{g} \right)+{{\text{O}}_{2}}\left( \text{g} \right)=2\text{C}{{\text{O}}_{2}}\left( \text{g} \right)$②,${{\text{N}}_{2}}\left( \text{g} \right)+2{{\text{O}}_{2}}\left( \text{g} \right)=2\text{N}{{\text{O}}_{2}}\left( \text{g} \right)$③,方程式①$\rm +$②$\rm -$③可得方程式$2\text{NO}\left( \text{g} \right)+2\text{CO}\left( \text{g} \right)\rightleftharpoons {{\text{N}}_{2}}\left( \text{g} \right)+2\text{C}{{\text{O}}_{2}}\left( \text{g} \right)$,由盖斯定律得$\Delta H=\Delta {{H}_{1}}+\Delta {{H}_{2}}-\Delta {{H}_{3}}=-644\;\rm \text{kJ}\cdot \text{mo}{{\text{l}}^{-1}}$;$2\text{NO}\left( \text{g} \right)+2\text{CO}\left( \text{g} \right)\rightleftharpoons {{\text{N}}_{2}}\left( \text{g} \right)+2\text{C}{{\text{O}}_{2}}\left( \text{g} \right)\qquad\Delta H\lt 0$,由于反应后气体的物质的量减少,则$\Delta S\lt 0$,则反应在低温下自发进行。
用金作催化剂,$\text{CO}\left( \text{g} \right)+{{\text{H}}_{2}}\text{O}\left( \text{g} \right)\rightleftharpoons\text{C}{{\text{O}}_{2}}\left( \text{g} \right)+{{\text{H}}_{2}}\left( \text{g} \right)$的反应历程如下图所示,其中吸附在金催化剂表面上的微粒用“*”标注。该历程中最大能垒${{E}_正}=$ $ \text{eV}$,写出该步骤的化学方程式: 。
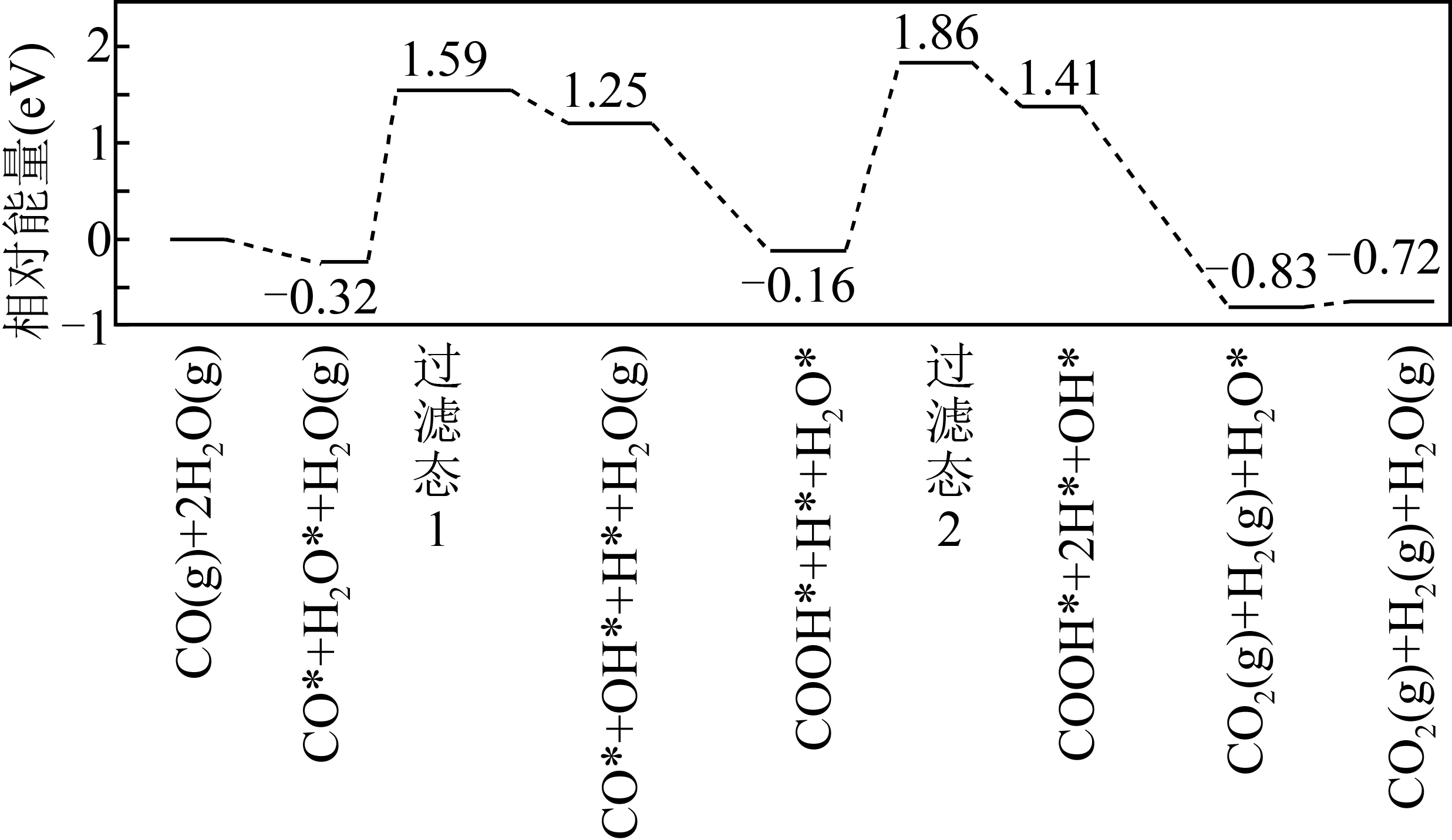
$\\rm 2.02$;$\\text{COOH}\\cdot +\\text{H}\\cdot +{{\\text{H}}_{2}}\\text{O}\\cdot =\\text{COOH}\\cdot +2\\text{H}\\cdot +\\text{OH}\\cdot \\rm ($或${{\\text{H}}_{2}}\\text{O}\\cdot =\\text{H}\\cdot +\\text{OH}\\cdot \\rm )$
"]]$\text{CO}\left( \text{g} \right)+{{\text{H}}_{2}}\text{O}\left( \text{g} \right)\rightleftharpoons \text{C}{{\text{O}}_{2}}\left( \text{g} \right)+{{\text{H}}_{2}}\left( \text{g} \right)$的反应历程中,最大能垒过程应为中间产物与过渡态之间能量差值最大的过程,过渡态Ⅰ过程能量差值为$1.91\;\rm \text{eV}$,过渡态Ⅱ过程能量差值为$2.02\;\rm \text{eV}$,因此最大能垒${{E}_正}=2.02\;\rm \text{eV}$;该过程的化学方程式为$\text{COOH}*+\text{H}*+{{\text{H}}_{2}}\text{O}*=\text{COOH}*+2\text{H}*+\text{OH}*$或${{\text{H}}_{2}}\text{O}*=\text{H}*+\text{OH}*$。
将相同量的$\text{NO}$和$\text{CO}$分别充入盛有催化剂$(1)$和$(2)$的体积相同的密闭容器,进行反应:$2\text{NO}\left( \text{g} \right)+2\text{CO}\left( \text{g} \right)\rightleftharpoons{{\text{N}}_{2}}\left( \text{g} \right)+2\text{C}{{\text{O}}_{2}}\left( \text{g} \right)$,经过相同时间内测量两容器中$\text{NO}$的含量,从而确定$\text{NO}$的转化率,结果如下图所示。试判断图像中$\rm {c}$点是否一定处于平衡状态并分析原因: 。
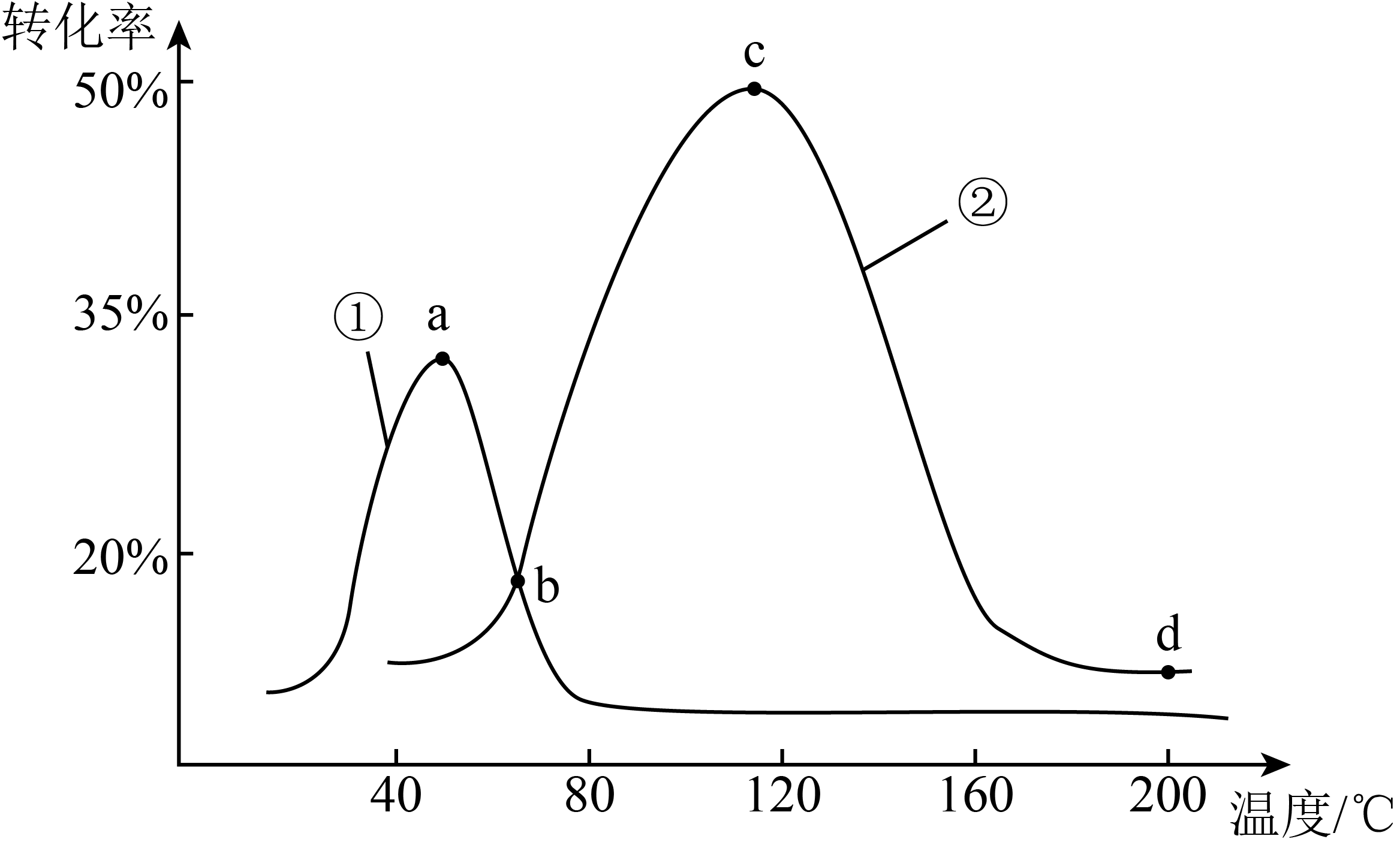
因为$\\rm c$点虽然$\\rm NO$的转化率最高,在相同时间内反应的$\\rm NO$最多,但只能说明反应速率最快,而影响反应速率的因素除了温度,还有催化剂的活性,而催化剂的活性还受到温度的影响,有可能$\\rm c$点还未平衡,但由于催化剂迅速失去活性,导致反应速率减慢,使$\\rm NO$转化率降低,若在$\\rm c$点提供更长时间,$\\rm NO$转化率还会继续增大,最终达到平衡时$\\rm NO$的转化率高于$\\rm c$点$\\rm NO$的转化率
"]]$\rm c$点不一定是平衡状态,因为$\rm c$点虽然$\rm NO$的转化率最高,在相同时间内反应的$\rm NO$最多,但只能说明反应速率最快,而影响反应速率的因素除了温度,还有催化剂的活性,而催化剂的活性还受到温度的影响,有可能$\rm c$点还未平衡,但由于催化剂迅速失去活性,导致反应速率减慢,使$\rm NO$转化率降低,若在$\rm c$点提供更长时间,$\rm NO$转化率还会继续增大,最终达到平衡。
$\left[ \text{Co}{{\left( 15-\text{-5)}{{\left( {{\text{H}}_{2}}\text{O} \right)}_{2}} \right]}^{2+}} \right.\rm ($“$\rm 15-$冠$\rm -5$”是指冠醚的环上原子总数为$\rm 15$,其中$\mathrm{O}$原子数为$\rm 5)$是一种配位离子,该配位离子的结构示意图如图$\rm 1$所示$\rm ({{\text{H}}_{2}}\text{O}$也是配体之一$\rm )$,该配位离子中含有的$\sigma $键数目为 。全惠斯勒合金$\text{C}{{\text{r}}_{x}}\text{C}{{\text{o}}_{y}}\text{A}{{\text{l}}_{z}}$的晶胞结构如图$\rm 2$所示,其化学式为 ;已知该晶胞的边长为$a\text{ pm}$,则全惠斯勒合金的密度为 $\rm g/cm^{3}$。
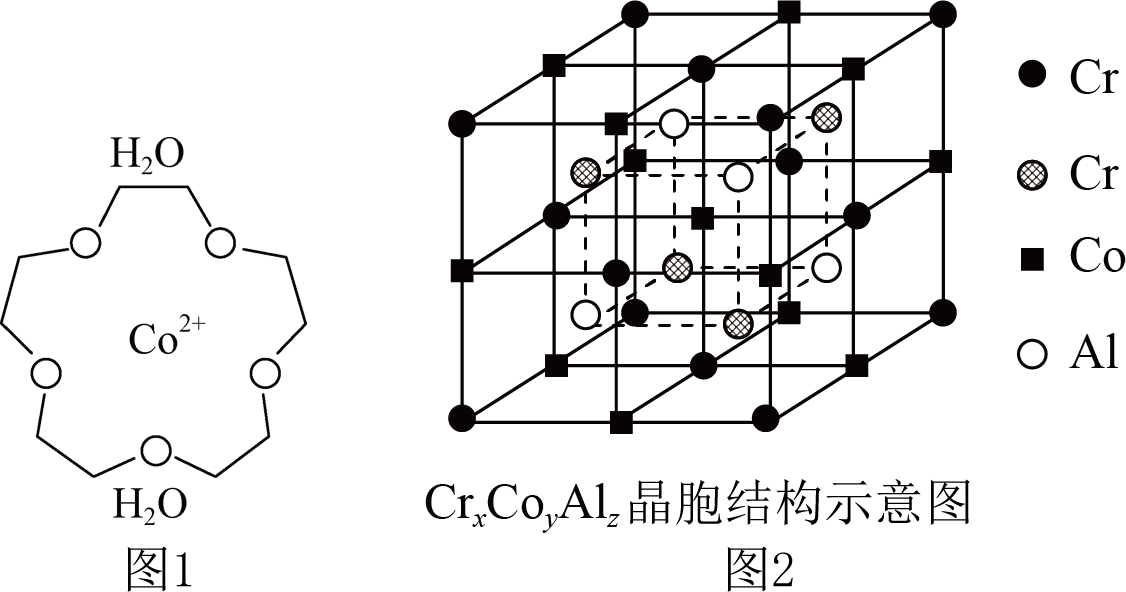
$\\rm 46$;$\\text{C}{{\\text{r}}_{2}}\\text{CoAl}$;$\\dfrac{760}{{{N}_{\\text{A}}}\\times {{a}^{3}}\\times {{10}^{-30}}}$
"]]冠醚分子中含有碳氢键$\rm 2\times 10=20$个,环上有碳氧键和碳碳键共$\rm 15$个,$\rm 2$个$\rm {{ {H}}_{2}} {O}$分子中$\rm 4$个氢氧键,同时配位离子中的配位键也为$\rm \sigma $键,$\rm 7$个配体,配位键共有$\rm 7$个,则该配位离子中含有的$\rm \sigma $键数目为$\rm 15+2\times 10+2\times 2+7=46$;顶点粒子占$\rm \dfrac{1}{8}$,面上粒子占$\rm \dfrac{1}{2}$,棱上粒子占$\rm \dfrac{1}{4}$,内部粒子为整个晶胞所有,所以一个晶胞中含有$\rm {Cr}$的数目为$\rm 8\times \dfrac{1}{8}+6\times \dfrac{1}{2}+4\times 1=8$,含有$\rm {Co}$的数目为$\rm 12\times \dfrac{1}{4}+1\times 1=4$,含有$\rm {Al}$的数目为$\rm 4\times 1=4$,所以晶体化学式为$\rm {C}{{ {r}}_{2}} {CoAl}$;已知该晶胞的边长为$a\;\rm pm$,体积$V=a^{3}\times 10^{-30}\;\rm cm^{3}$,晶胞中含有$\rm 8$个$\rm Cr$、$\rm 4$个$\rm Co$和$\rm 1$个$\rm Al$,晶胞的质量为$ m=\dfrac{760}{{{ {N}}_{ \rm{A}}}}\;\rm \rm g$,则全惠斯勒合金的密度为$ \rho=\dfrac{ {m}}{ {V}} =\dfrac{ {760}}{{{ {N}}_{\rm {A}}} \times {{ {a}}^{ {3}}} \times { 1}{{ {0}}^{ {-30}}}}\;\rm \rm g/cm^{3}$。
高中 | 配合物理论题目答案及解析(完整版)
