高中 | 配合物理论 题目答案及解析
稿件来源:高途
高中 | 配合物理论题目答案及解析如下,仅供参考!
选修三
第二章 分子结构与性质
第二节 分子的立体结构
配合物理论
硼化钛$\left( \text{Ti}{{\text{B}}_{2}} \right)$强度高、硬度大,广泛应用于机械制造领域;五氟化锑$\left( \text{Sb}{{\text{F}}_{5}} \right)$是一种高能氟化剂,广泛应用于制药业。工业上以一种含钛的矿渣$\rm ($主要含$\text{Ti}{{\text{O}}_{2}}$、$\text{S}{{\text{b}}_{2}}{{\text{O}}_{3}}$、$\rm ZnO$、$\rm PbO$、$\rm NiO$、$\rm CoO)$为原料制取硼化钛和五氟化锑的流程如图$\rm 1$所示。
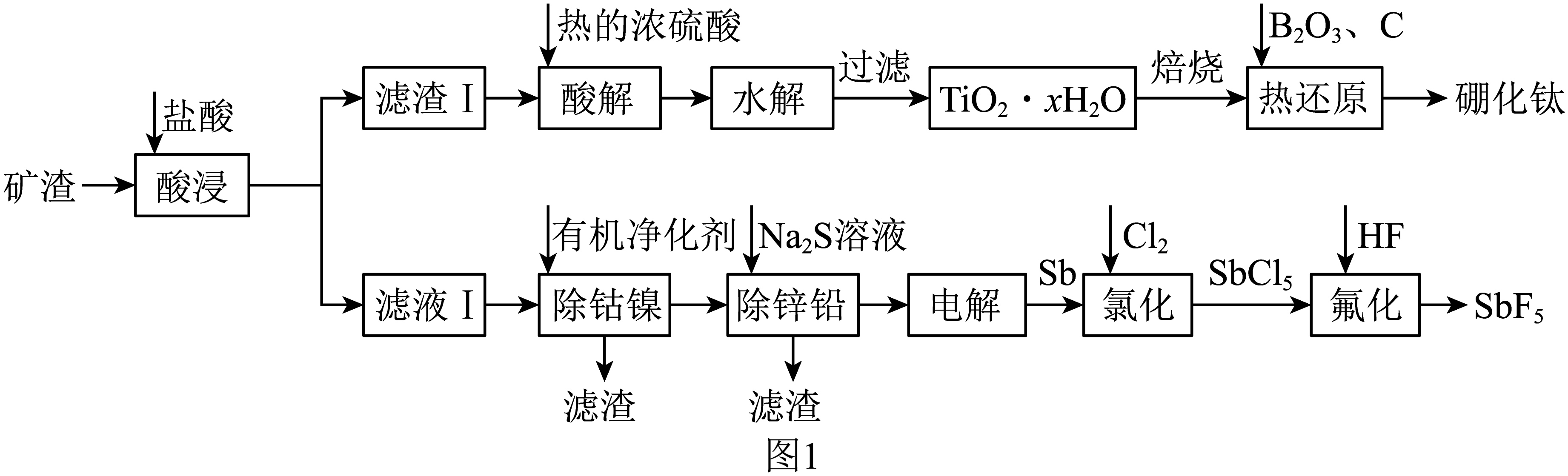
已知:①$\text{Ti}{{\text{O}}_{2}}$性质较稳定,加热时可溶于浓硫酸中形成$\text{Ti}{{\text{O}}^{2+}}$;
②高温下${{\text{B}}_{2}}{{\text{O}}_{3}}$易挥发;
③“热还原”步骤主要反应为$\text{Ti}{{\text{O}}_{2}}+{{\text{B}}_{2}}{{\text{O}}_{3}}+5\text{C}\begin{matrix} \underline{\underline{高温}} \\ {} \\ \end{matrix}\text{Ti}{{\text{B}}_{2}}+5\text{CO}\uparrow $;
④$25$时,$\rm ZnS$、$\rm PbS$的${{K}_{\text{sp}}}$分别为$1.6 \times 10^{-24}$、$8.0\times {{10}^{-28}}$。
回答下列问题:
“水解”步骤中对应的离子方程式为 。为了使水解趋于完全,可采取的措施有 $\rm ($填一条$\rm )$。
$\\text{Ti}{{\\text{O}}^{2+}}+\\left( {x+1} \\right){{\\text{H}}_{2}}\\text{O}=\\text{Ti}{{\\text{O}}_{2}}\\cdot {x}{{\\text{H}}_{\\text{2}}}\\text{O}\\downarrow +2{{\\text{H}}^{+}}$;加碱$\\rm ($或“加热”$\\rm )$
"]]结合分析可知,“水解”步骤中$\text{Ti}{{\text{O}}^{2+}}$转变为$\text{Ti}{{\text{O}}_{2}}\cdot {x}{{\text{H}}_{\text{2}}}\text{O}$沉淀,对应的离子方程式为$\text{Ti}{{\text{O}}^{2+}}+\left( {x+1} \right){{\text{H}}_{2}}\text{O}=\text{Ti}{{\text{O}}_{2}}\cdot {x}{{\text{H}}_{\text{2}}}\text{O}\downarrow +2{{\text{H}}^{+}}$。为了使水解趋于完全,应使水解平衡正向移动,故可采取的措施有加$\text{NaOH}$等碱溶液、加热等。$\rm ($填一条$\rm )$。
“热还原”步骤中使用石墨化炉高温加热装置$\rm (1500\sim 2100\rm \;^\circ \rm C )$,${{\text{B}}_{2}}{{\text{O}}_{3}}$的实际用量超过理论化学计量所要求的量,原因是 。仅增大配料中${{\text{B}}_{2}}{{\text{O}}_{3}}$的用量,产品中的杂质含量变化如图$\rm 2$所示。杂质$\rm TiC$含量随$w \% ({{\text{B}}_{2}}{{\text{O}}_{3}}$量相对理论化学计量过量百分比$\rm )$增大而降低的原因可能是 $\rm ($用化学方程式解释$\rm )$。
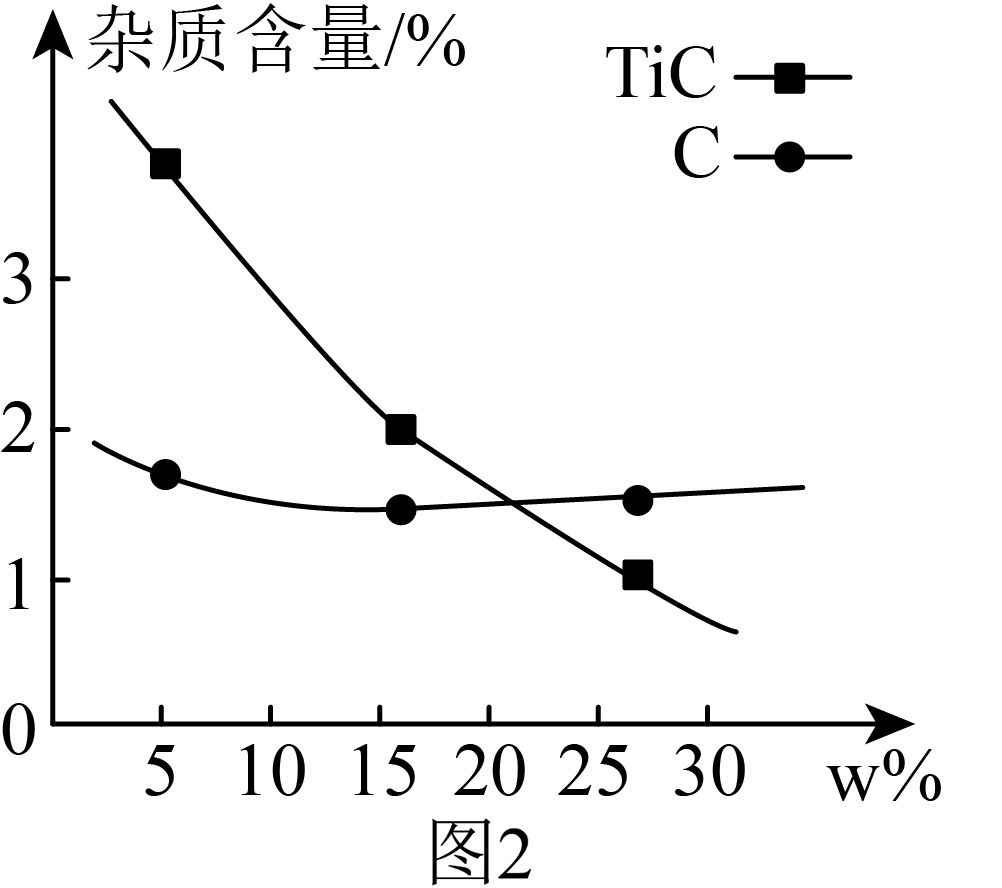
${{\\text{B}}_{2}}{{\\text{O}}_{3}}$在高温下易挥发,反应不充分;$\\text{TiC}+{{\\text{B}}_{2}}{{\\text{O}}_{3}}+\\text{CO}\\begin{matrix} \\underline{\\underline{高温}} \\\\ {} \\\\ \\end{matrix}\\text{Ti}{{\\text{B}}_{2}}+2\\text{C}{{\\text{O}}_{2}}$
"]]“热还原”步骤中使用石墨化炉高温加热装置$\rm (1500\sim 2100\rm )$,则“热还原”步骤中发生氧化还原反应,$\rm B$元素的化合价从$\rm +3$价变为$\rm -2$价,$\rm C$元素的化合价从$\rm 0$价变为$\rm +4$价,反应方程式为$\text{2Ti}{{\text{O}}_{\text{2}}}\cdot {x}{{\text{H}}_{\text{2}}}\text{O+2}{{\text{B}}_{\text{2}}}{{\text{O}}_{\text{3}}}\text{+5C }\begin{array}{*{20}{c}}{\underline{\underline {1450\sim1550\;^\circ \rm C}} }\\{}\end{array}\text{ 2Ti}{{\text{B}}_{\text{2}}}\text{+5C}{{\text{O}}_{\text{2}}}\uparrow +2x {{\text{H}}_{\text{2}}}\text{O}$,已知高温下${{\text{B}}_{2}}{{\text{O}}_{3}}$易挥发,则${{\text{B}}_{2}}{{\text{O}}_{3}}$的实际用量超过理论化学计量所要求的量的原因是:${{\text{B}}_{2}}{{\text{O}}_{3}}$在高温下易挥发,反应不充分。仅增大配料中${{\text{B}}_{2}}{{\text{O}}_{3}}$的用量,$\rm TiC$含量随着降低,$\rm C$的含量先减少后基本不变,则$\rm C$转变为$\rm CO$、$\rm CO$与${{\text{B}}_{2}}{{\text{O}}_{3}}$和$\rm TiC$反应转化为$\rm TiB_{2}$,则产品中杂质$\rm TiC$含量随$w\\% ({{\text{B}}_{2}}{{\text{O}}_{3}}$量相对理论化学计量过量百分比$\rm )$增大而降低的原因可能是:$\text{TiC}+{{\text{B}}_{2}}{{\text{O}}_{3}}+\text{CO}\begin{matrix} \underline{\underline{高温}} \\ {} \\ \end{matrix}\text{Ti}{{\text{B}}_{2}}+2\text{C}{{\text{O}}_{2}}$ $\rm ($用化学方程式解释$\rm )$。
“除钴镍”步骤中,有机净化剂的基本组分为大分子立体网格结构的聚合物,其净化原理如图$\rm 3$所示。$\text{C}{{\text{o}}^{2+}}$、$\text{N}{{\text{i}}^{2+}}$能发生上述转化而$\text{Z}{{\text{n}}^{2+}}$不能,推测可能的原因为 。
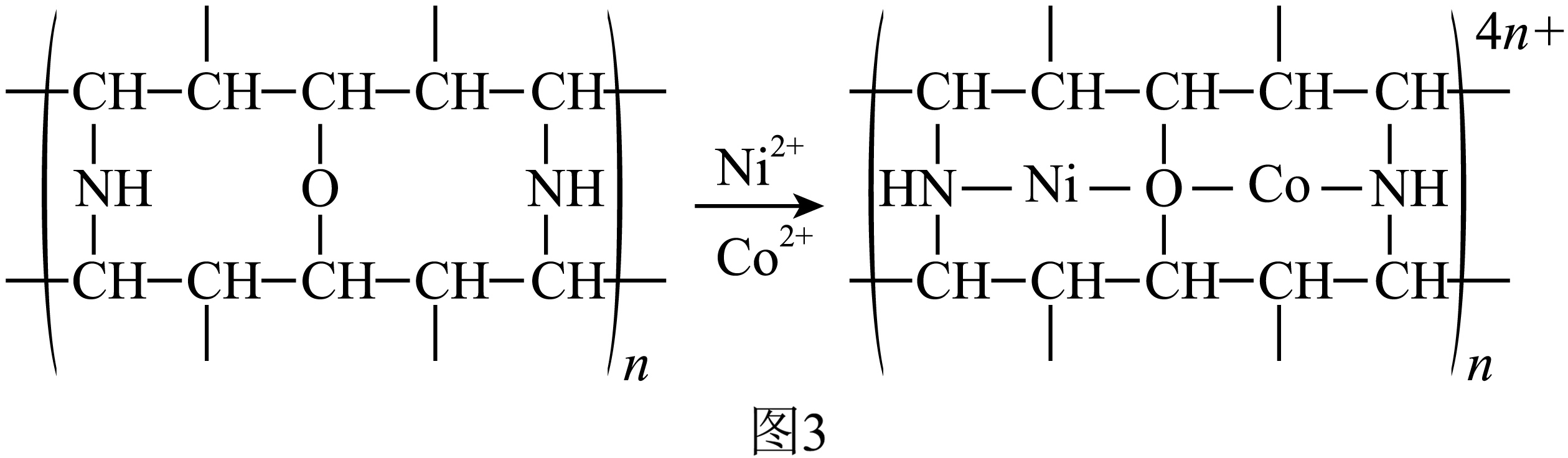
$\\text{C}{{\\text{o}}^{2+}}$、$\\text{N}{{\\text{i}}^{2+}}$半径与有机净化剂网格孔径大小匹配,可形成配位键,而$\\text{Z}{{\\text{n}}^{2+}}$不匹配
"]]“除钴镍”步骤中,有机净化剂的基本组分为大分子立体网格结构的聚合物,其净化原理如图$\rm 3$所示,由图可知,$\text{C}{{\text{o}}^{2+}}$、$\text{N}{{\text{i}}^{2+}}$分别与$\rm N$、$\rm O$形成了配位键,则$\text{C}{{\text{o}}^{2+}}$、$\text{N}{{\text{i}}^{2+}}$能发生上述转化而$\text{Z}{{\text{n}}^{2+}}$不能,推测可能的原因为:$\text{C}{{\text{o}}^{2+}}$、$\text{N}{{\text{i}}^{2+}}$半径与有机净化剂网格孔径大小匹配,可形成配位键,而$\text{Z}{{\text{n}}^{2+}}$不匹配。
已知滤液Ⅰ中$c\left( \text{Z}{{\text{n}}^{2+}} \right)=0.01\;\rm \text{mol}\cdot {{\text{L}}^{-1}}$,$c\left( \text{P}{{\text{b}}^{2+}} \right)=0.001\;\rm \text{mol}\cdot {{\text{L}}^{-1}}$。“除锌铅”步骤中,缓慢滴加稀$\text{N}{{\text{a}}_{2}}\text{S}$溶液,先产生的沉淀是 $\rm ($填化学式$\rm )$;当$\rm ZnS$、$\rm PbS$共沉时,先沉淀的物质 $\rm ($填“已”“未”$\rm )$沉淀完全$\rm ($离子浓度$\lt 1.0\times {{10}^{-5}}\;\rm \text{mol}\cdot {{\text{L}}^{-1}}\rm )$。
$\\rm PbS$;已
"]]由溶度积可知,锌离子、铅离子开始沉淀时硫离子的浓度分别为$\dfrac{\text{1}\mathrm{}\text{6}\times \text{1}{{0}^{-24}}}{0.01}\text{ mol/L}=\text{1}\mathrm{}\text{6}\times \text{1}{{0}^{-22}}\text{ mol/L}$,$\dfrac{\text{8}\mathrm{}0\times \text{1}{{0}^{-28}}}{0.001}\;\rm { mol/L=8}\mathrm{}0\times \text{1}{{0}^{-25}}\text{ mol/L}$,则转化为硫化物沉淀时所需硫离子浓度,铅离子的小于锌离子的,故先产生的沉淀是$\rm PbS$;当$\rm ZnS$、$\rm PbS$共沉时,硫离子浓度为$\dfrac{\text{1}\mathrm{}\text{6}\times \text{1}{{0}^{-24}}}{0.01}\rm\;{ mol/L}=\text{1}\mathrm{}\text{6}\times \text{1}{{0}^{-22}}\text{ mol/L}$,则铅离子的浓度为$\dfrac{\text{8}\mathrm{}0\times \text{1}{{0}^{-28}}}{1.6\times \text{1}{{0}^{-22}}}\;\rm{ mol/L=5}\times \text{1}{{0}^{-6}}\text{ mol/L 1}\times \text{1}{{0}^{-5}}\text{ mol/L}$,故$\rm PbS$已经沉淀完全。
制取$\text{Sb}{{\text{F}}_{5}}$时,没有选择玻璃仪器,其原因为 $\rm ($用化学方程式表示$\rm )$。
$\\text{Si}{{\\text{O}}_{2}}+4\\text{HF}=\\text{Si}{{\\text{F}}_{4}}\\uparrow +2{{\\text{H}}_{2}}\\text{O}$
"]]氢氟酸能腐蚀玻璃,则制取$\text{Sb}{{\text{F}}_{5}}$时,没有选择玻璃仪器的原因为:$\text{Si}{{\text{O}}_{2}}+4\text{HF}=\text{Si}{{\text{F}}_{4}}\uparrow +2{{\text{H}}_{2}}\text{O} ($用化学方程式表示$\rm )$。
高中 | 配合物理论题目答案及解析(完整版)
