高中 | 配合物理论 题目答案及解析
稿件来源:高途
高中 | 配合物理论题目答案及解析如下,仅供参考!
选修三
第二章 分子结构与性质
第二节 分子的立体结构
配合物理论
某课外活动小组以$\rm CuSO_{4}·5H_{2}O$和氨水为原料制备$\rm [Cu(NH_{3})_{4}]SO_{4}·H_{2}O$并进行探究。
已知:$\rm CuSO_{4}+4NH_{3}·H_{2}O=$ $\rm [Cu(NH_{3})_{4}]SO_{4}+4H_{2}O$
$\rm [Cu(NH_{3})_{4}]SO_{4}=[Cu(NH_{3})_{4}]^{2+}$ $\rm +SO_{4}^{2-}$
$\rm [Cu(NH_{3})_{4}]^{2+}$ $\rm +4H^{+}$ $\rm =Cu^{2+}$ $\rm +4NH_{4}^{+}$
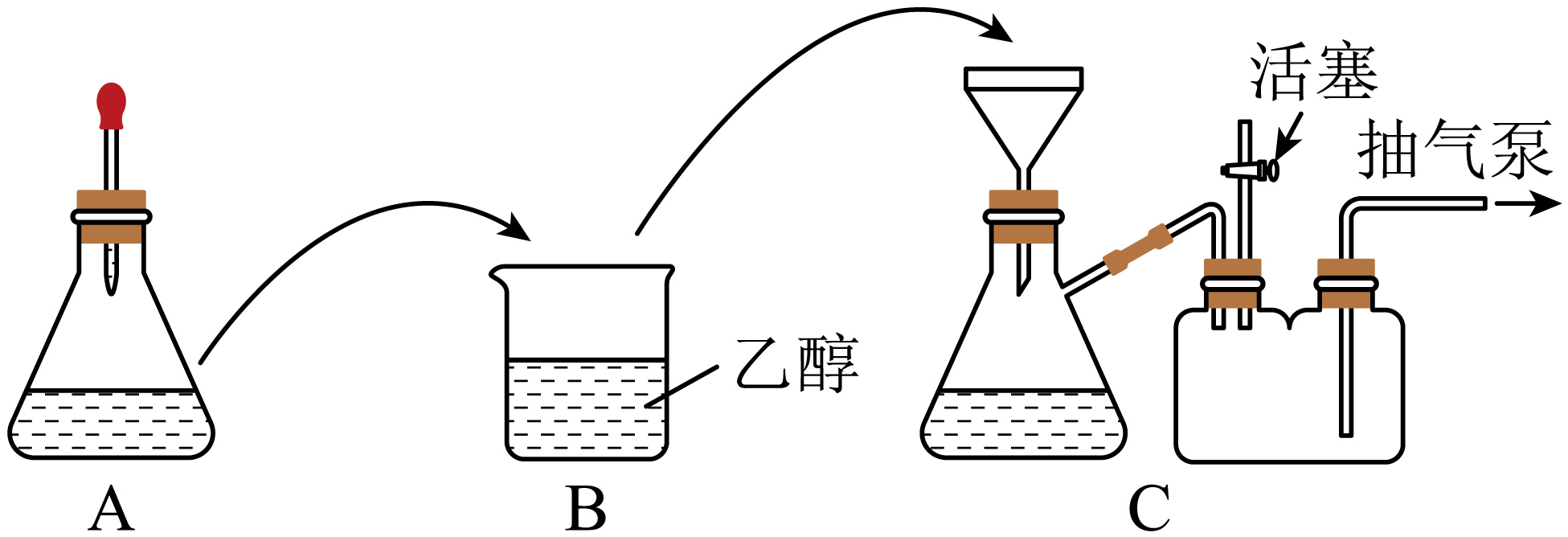
配制溶液:称取一定质量的$\rm CuSO_{4}·5H_{2}O$晶体,放入锥形瓶中,溶解后滴加氨水。装置如图$\rm A$所示$\rm ($胶头滴管中吸有氨水$\rm )$。
滴加氨水时,有浅蓝色沉淀$\rm Cu_{2}(OH)_{2}SO_{4}$生成;继续滴加氨水,沉淀消失,得到深蓝色的$\rm [Cu(NH_{3})_{4}]SO_{4}$溶液。用离子方程式表示由浅蓝色沉淀得到深蓝色溶液的原理:
$\\rm Cu_{2}(OH)_{2}SO_{4}+8NH_{3}·H_{2}O=2[Cu(NH_{3})_{4}]^{2+} \\rm +SO_{4}^{2-}\\rm +2OH^{-} \\rm +8H_{2}O$
"]]$\rm CuSO_{4}·5H_{2}O$晶体溶解后滴加氨水,生成浅蓝色沉淀$\rm Cu_{2}(OH)_{2}SO_{4}$;继续滴加氨水,得到深蓝色溶液$\rm [Cu(NH_{3})_{4}]SO_{4}$,反应过程中氨水中的一水合氨或氨气参加反应,$\rm [Cu(NH_{3})_{4}]SO_{4}$为可溶性强电解质,在水溶液中完全电离,离子方程式为:$\rm Cu_{2}(OH)_{2}SO_{4}+8NH_{3}·H_{2}O=2[Cu(NH_{3})_{4}]^{2+} \rm +SO_{4}^{2-}\rm +2OH^{-} \rm +8H_{2}O$。
制备晶体:将$\rm A$中溶液转移至$\rm B$中,析出$\rm [Cu(NH_{3})_{4}]SO_{4}·H_{2}O$晶体;将$\rm B$中混合物转移至$\rm C$的漏斗中,减压过滤,用乙醇洗涤晶体$\rm 2\sim 3$次;取出晶体,冷风吹干。
①晶体不采用加热烘干的原因是
②减压过滤时,抽气泵处于工作状态,活塞需关闭,使装置内产生负压。洗涤晶体时,应该在打开活塞的状态下,向漏斗中加入乙醇至浸没沉淀,原因是 。
晶体受热易脱水脱氨$\\rm ($“晶体受热易分解”或“加热烘干变质”$\\rm )$;为了使乙醇较慢的从漏斗中流出来并与晶体充分接触,提高洗涤的效果
"]]①晶体不采用加热烘干的原因是防止失去结晶水,降低产物产率;
②装置内产生负压时,漏斗中液体会被迅速抽入吸滤瓶中,而洗涤过程为了使乙醇较慢的从漏斗中流出来并与晶体充分接触,提高洗涤的效果,需打开活塞。
废液回收:从含有$\rm [Cu(NH_{3})_{4}]SO_{4}$、乙醇和氨水的废液中回收乙醇并获得$\rm CuSO_{4}$和$\rm (NH_{4})_{2}SO_{4}$的混合溶液,应加入的试剂是$\rm (\quad\ \ \ \ )\rm ($填序号$\rm )$
$\rm A$.盐酸 $\rm B$.硝酸 $\rm C$.硫酸 $\rm D$.氢氧化钠溶液。
已知硫酸铵溶液高温易分解,回收乙醇的实验方法为$\rm (\quad\ \ \ \ )$
$\rm A$.蒸馏 $\rm B$.减压蒸馏 $\rm C$.萃取 $\rm D$.分液
$\\rm C$;$\\rm B$
"]]该过程需要将$\rm [Cu(NH_{3})_{4}]SO_{4}$转化为$\rm CuSO_{4}$,氨水中一水合氨和氨气转化为$\rm (NH_{4})_{2}SO_{4}$,类似于$\rm NH_{3}→(NH_{4})_{2}SO_{4}$,应加入的试剂是硫酸,故选:$\rm C$;充分反应后溶液为无机盐和乙醇的水溶液,回收乙醇是液液互溶体系分离,回收乙醇的实验方法为蒸馏,为防止硫酸铵分解,需减压蒸馏,降低蒸馏所需温度,故选:$\rm B$。
用沉淀法测定晶体中$\rm SO_{4}^{2-}$的含量。称取一定质量的$\rm [Cu(NH_{3})_{4}]SO_{4}·H_{2}O$晶体,加适量蒸馏水溶解,向其中滴加足量$\rm BaCl_{2}$溶液,搅拌,加热一段时间,过滤,洗涤,烘干,灼烧,称量沉淀的质量。下列有关说法正确的有$(\quad\ \ \ \ )$。
滴加足量$\\rm BaCl_{2}$溶液能降低实验数值偏低的可能性
","检验沉淀已经洗净的方法为取少量最后一次洗涤液于试管中,向其中加入$\\rm BaCl_{2}$溶液,无白色沉淀生成,证明沉淀已洗净
","洗涤后滤纸和固体一起灼烧,以免固体附着在滤纸上,造成损失。
","已知$\\rm [Cu(NH_{3})_{4}]^{2+}$ 为平面四边形结构,中心$\\rm Cu^{2+}$不可能是$\\rm sp^{3}$杂化
"]$\rm A$.足量$\rm BaCl_{2}$溶液可以使硫酸根完全沉淀,降低实验数值偏低的可能性,$\rm A$正确;
$\rm B$.沉淀表明的杂质主要为氯离子,检验沉淀已经洗净即检验是否有氯离子,应取最后一次洗涤液,向其中加入$\rm AgNO_{3}$溶液,若无白色沉淀产生,证明沉淀洗净,$\rm B$错误;
$\rm C$.洗涤后滤纸和固体一起灼烧,可以保证所有沉淀均被回收,$\rm C$正确;
$\rm D$.若$\rm Cu^{2+}$为$\rm sp^{3}$杂化,则其空间构型应为正四面体形,而不是正方形,$\rm D$正确;
故答案为:$\rm ACD$。
新制的氨水中含氮元素的微粒有$\rm 3$种:$\rm NH_{3}$、$\rm NH_{3}·H_{2}O$和$\rm NH_{4}^{+}$,其中$\rm NH_{3}·H_{2}O$电离平衡受多种因素的影响。设计实验,控制变量,仅探究$\rm NH_{4}^{+}$对$\rm NH_{3}·H_{2}O$电离平衡的影响结果:
①限制试剂与仪器:$\rm 0.1\;\rm mol/L$氨水、$\rm NH_{4}Cl$、$\rm CH_{3}COONH_{4}$、$\rm NH_{4}HCO_{3}$、$\rm (NH_{4})_{2}CO_{3}$、量筒、烧杯、玻璃棒、药匙、天平、$\rm pH$计、恒温水浴槽$\rm ($可控制温度$\rm )$。
②设计实验方案,拟定实验表格,完整体现实验方案。表格中“ ”处需测定的物理量为
物理量 实验序号 | $ V(0.1\;\rm mol/L$氨水$\rm )/mL$ | $ m($铵盐$\rm )/g$ | $ t/^\circ\rm C$ | |
| $\rm 1$ | $\rm 100$ | $\rm 0$ | $\rm 25$ | $b$ |
| $\rm 2$ | $\rm 100$ | $a$ | $\rm 25$ | $c$ |
③表中物理量“$ m($铵盐$\rm )/g$”的铵盐应是
④按实验序号$\rm 2$所拟数据进行实验,忽略水电离的$\rm OH^{-}$,则一水合氨的电离度$\rm ($平衡转化率$\rm )$为 。
$\\rm pH$;$\\rm NH_{4}Cl$;$\\alpha =\\dfrac{{{10}^{{c}-14}}}{0.1}\\times 100\\%={{10}^{{c}-13}} \\%$
"]]②本实验的目的是探究影响$\rm NH_{3}·H_{2}O$电离平衡的因素,$\rm NH_{3}·H_{2}O$电离平衡受到影响时,溶液的$\rm pH$会发生变化,所以还需测定的物理量为$\rm pH$;
③$\rm CH_{3}COONH_{4}$、$\rm NH_{4}HCO_{3}$、$\rm (NH_{4})_{2}CO_{3}$所含的酸根均为弱酸根,弱酸根会发生水解,影响溶液$\rm pH$,所以铵盐应选用$\rm NH_{4}Cl$;
④一水合氨的电离平衡:$\rm NH_{3}·H_{2}O\rightleftharpoons \rm NH_{4}^{+}\rm +OH^{-}$,溶液${\rm pH}=c$,则${c\rm (H^{+})}=10^{-c}\rm \;mol/L$、$ c{\rm (OH^{-})}=10^{c-14}\;\rm mol/L$,忽略水电离的$\rm OH^{-}$,所以氢氧根全部由一水合氨电离,则一水合氮的电离度$\alpha =\dfrac{{{10}^{{c}-14}}}{0.1}\times 100\%={{10}^{{c}-13}} \%$。
高中 | 配合物理论题目答案及解析(完整版)
