高中 | 化学平衡常数 题目答案及解析
稿件来源:高途
高中 | 化学平衡常数题目答案及解析如下,仅供参考!
选修四
第二章 化学反应速率和化学平衡
第三节 化学平衡
化学平衡常数
$\rm CO_{2}$催化加氢制甲醇是极具前景的温室气体资源化研究领域。 在某 $\rm CO_{2}$催化加氢制甲醇的反应体系中,发生的主要反应有:
$\rm i$.${\rm CO_{2}(g)+3H_{2}(g)\underset{{}}{\overset{{}}{\mathop{\rightleftharpoons }}}\,\rm CH_{3}OH(g)+H_{2}O(g)}\qquad \Delta H_{1}$
ⅱ.${\rm CO_{2}(g)+H_{2}(g) \underset{{}}{\overset{{}}{\mathop{\rightleftharpoons }}}\,\rm CO(g)+H_{2}O(g)}\qquad \Delta H_{2}=+41\;\rm kJ·mol^{-1}$
ⅲ.${\rm CO(g)+2H_{2}(g)\underset{{}}{\overset{{}}{\mathop{\rightleftharpoons }}}\,\rm CH_{3}OH(g)}\qquad \Delta H_{3}=-90\;\rm kJ·mol^{-1}$
回答下列问题:
$ \Delta H_{1}=$ $\rm kJ/mol$;
$\\rm -49\\;\\rm kJ·mol^{-1}$
"]]根据盖斯定律可知反应$\rm ii+iii$可得反应$\rm i$,所以$ \Delta H_{1}=\Delta H_{2}+\Delta H_{3}=+41\;\rm kJ·mol^{-1}+(-90\;\rm kJ·mol^{-1})=-49\;\rm kJ·mol^{-1}$。
若反应$\rm i$的$\rm \Delta S=-175\text{J}\cdot \text{mo}{{\text{l}}^{{-1}}}\cdot {{\text{K}}^{{-1}}}$下列温度下反应能自发进行的是$(\quad\ \ \ \ )\rm ($填标号$\rm )$。
$\\rm 5\\;\\rm ^\\circ\\rm C$
","$\\rm 20\\;\\rm ^\\circ\\rm C$
","$\\rm 100\\;\\rm ^\\circ\\rm C$
","$\\rm 200\\;\\rm ^\\circ\\rm C$
"]由上述小题可知:$\rm i$.${\rm CO_{2}(g)+3H_{2}(g)\underset{{}}{\overset{{}}{\mathop{\rightleftharpoons }}}\,\rm CH_{3}OH(g)+H_{2}O(g)}\qquad \Delta H_{1}-49\;\rm kJ·mol^{-1}$;$ \Delta S=-0.175\;\rm \text{kJ}\cdot \text{mo}{{\text{l}}^{{-1}}}\cdot {{\text{K}}^{{-1}}}$,当$\Delta G=\Delta H-T \Delta S\lt 0$的反应能自发进行,则${\rm -49\;\rm kJ·mol^{-1}}-T(-0.175\;\rm \text{kJ}\cdot \text{mo}{{\text{l}}^{{-1}}}\cdot {{\text{K}}^{{-1}}}\rm )\lt 0$,解得$ T\lt 280\;\rm K$,即温度低于$\rm 7\;\rm ^\circ\rm C$时反应能自发进行,故答案选$\rm A$。
已知几种化学键的键能数据如下表所示:
| 化学键 | $\rm C-H$ | $\rm O-H$ | $\rm C-O$ | $\rm H-H$ |
| 键能$\rm /(kJ·mol^{-1})$ | $\rm 413$ | $\rm 463$ | $\rm 351$ | $\rm 436$ |
则$\rm CO$中的$\rm C≡O$的键能 $\rm E=$ $\rm kJ/mol$;
$\\rm 1091$
"]]由$\Delta H_{3}=$反应物键能之和$\rm -$生成物键能之和,有${\rm -90\;\rm kJ·mol^{-1}}=(E+2\times \rm 436)-(3\times \rm 413+351+463)$ $\rm kJ·mol^{-1}$,解得$ E=1091\;\rm kJ·mol^{-1}$。
科学家结合实验与计算机模拟结果,研究了在金催化剂表面上发生的反应:$\rm CO(g)+H_{2}O(g) \underset{{}}{\overset{{}}{\mathop{\rightleftharpoons }}} CO_{2}(g)+H_{2}(g)$,反应历程如图所示,其中吸附在金催化剂表面上的物种用*标注
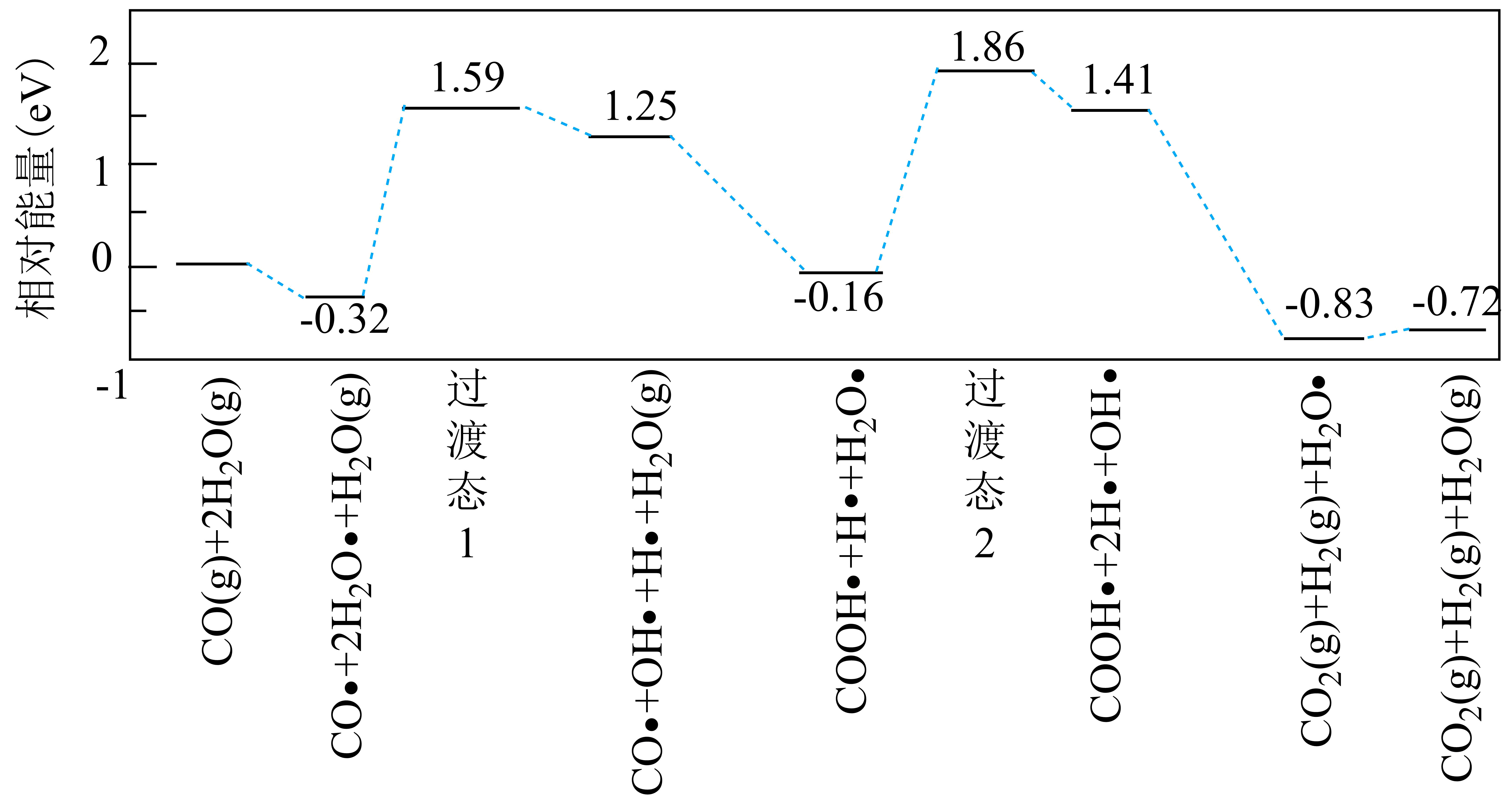
写出该历程中决速步骤的化学方程式:
$\\text{COOH}\\cdot \\text{+H}\\cdot +{{\\text{H}}_{\\text{2}}}\\text{O}\\cdot \\text{=COOH}\\cdot \\text{+2H}\\cdot \\text{+OH}\\cdot $或${{\\text{H}}_{\\text{2}}}\\text{O}\\cdot \\text{=H}\\cdot \\text{+OH}\\cdot $
"]]过渡态物质相对能量与始态物质相对能量差值越大,活化能越大,反应速率越慢,为整个过程的决速步反应,由图可知,最大活化能$E_\rm a=1.86\;\rm eV-(-0.16\;\rm eV)=2.02\;\rm eV$,该步骤的化学方程式为:$\text{COOH}\cdot \text{+H}\cdot +{{\text{H}}_{\text{2}}}\text{O}\cdot \text{=COOH}\cdot \text{+2H}\cdot \text{+OH}\cdot $或${{\text{H}}_{\text{2}}}\text{O}\cdot \text{=H}\cdot \text{+OH}\cdot $。
$\rm 10\; MPa$时,往某恒容密闭容器中按投料比$ n{\rm(CO_{2})}:n\rm(H_{2})=1:3$充入$\rm CO_{2}$和$\rm H_{2}$。反应达到平衡时,测得各组分的物质的量分数随温度变化的曲线如图所示
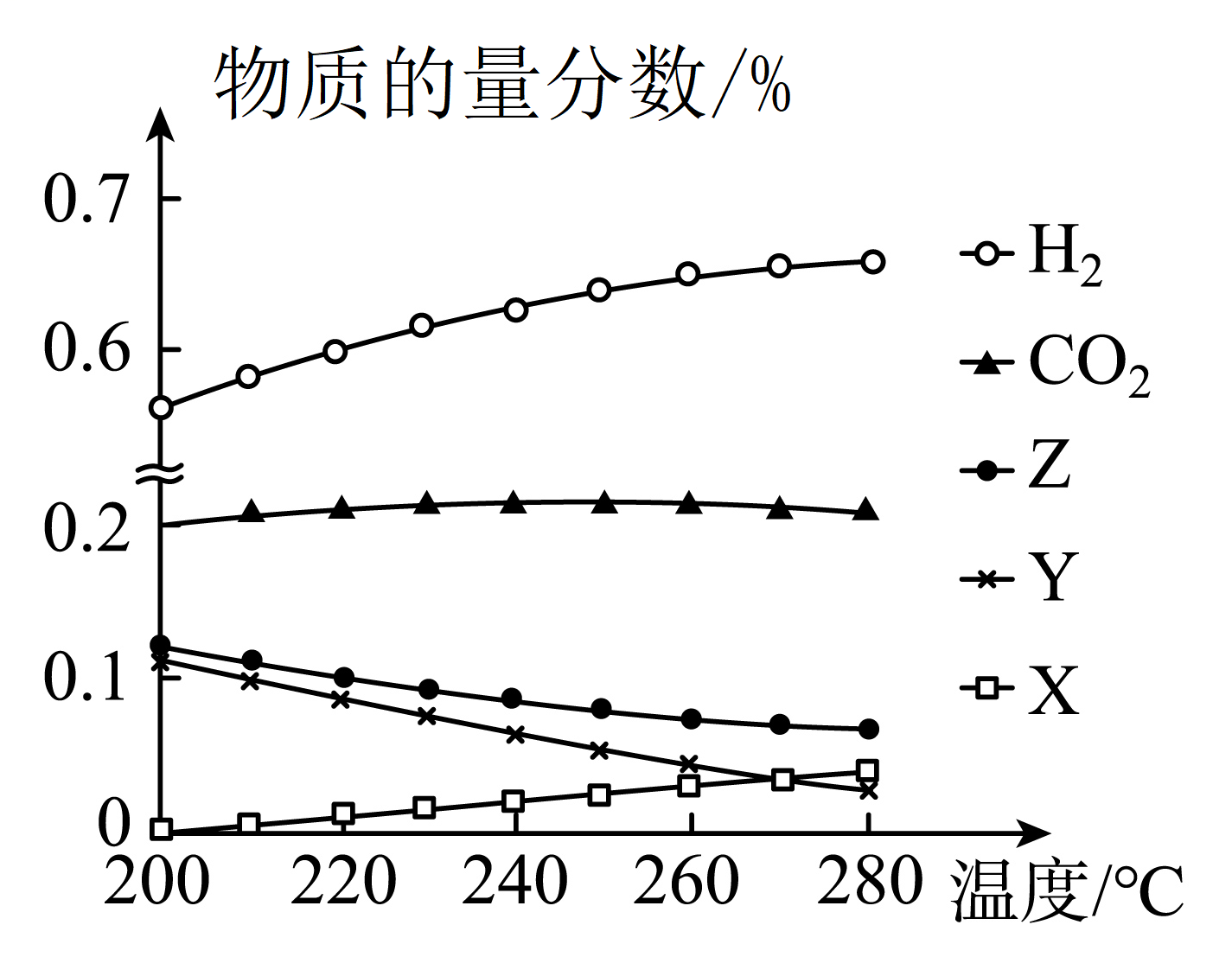
①图中$\rm 250\;\rm ^\circ\rm C$时,反应$\rm ii$的平衡常数 $\rm 1($填“$\rm \gt $”“$\rm \lt $”或“$\rm =$”$\rm )$。
②图中 $\rm X$、$\rm Y$分别代表 $\rm ($填化学式$\rm )$。
③温度一定时,增大压强,$\rm CO_{2}$平衡转化率 $\rm ($填“增大”“减小”或“不变”$\rm )$。
$\\rm \\lt $;$\\rm CO$、$\\rm CH_{3}OH$;增大
"]]①反应$\rm ii$平衡常数$ K=\dfrac{ {c\rm (CO)}\times {c(}{{\text{H}}_{\text{2}}}\text{O)}}{ {c\rm (C}{{\text{O}}_{\text{2}}}\text{)}\times {c(}{{\text{H}}_{\text{2}}}\text{)}}$,该反应前后气体体积计量数之和不变,所以可以用物质的量分数来代表浓度估算$K$值,据图可知$\rm 250\;\rm ^\circ\rm C$时,$\rm CO_{2}$与$\rm H_{2}$的物质的量分数大于$\rm CO$和$\rm H_{2}O$的物质的量分数,所以$K\lt 1$;
②$\Delta H_{1}\lt 0$,$\Delta H_{3}\lt 0$,即生成甲醇的反应均为放热反应,所以温度升高平衡时甲醇的物质的量分数应减小,$\Delta H_{2}\gt 0$生成$\rm CO$的反应为吸热反应,所以随温度升高$\rm CO$平衡时的物质的量分数会变大,二者共同作用导致水蒸气减小幅度小于甲醇,所以$\rm Z$代表$\rm H_{2}O$,$\rm Y$代表$\rm CH_{3}OH$,$\rm X$代表$\rm CO$;
③由反应$\rm i$、$\rm iii$是气体分子数减小的反应可知,增大压强,平衡正向移动,反应$\rm ii$是、气体分子数相等,压强对反应$\rm ii$没有影响,所以温度一定时,压强增大,$\rm CO_{2}$的平衡转化率增大。
高中 | 化学平衡常数题目答案及解析(完整版)
