高中 | 氯气 题目答案及解析
稿件来源:高途
高中 | 氯气题目答案及解析如下,仅供参考!
必修一
第四章 非金属及其化合物
第二节 富集在海水中的元素——氯
氯气
利用海水提取溴和镁的过程如下,下列说法不正确的是$(\qquad)$
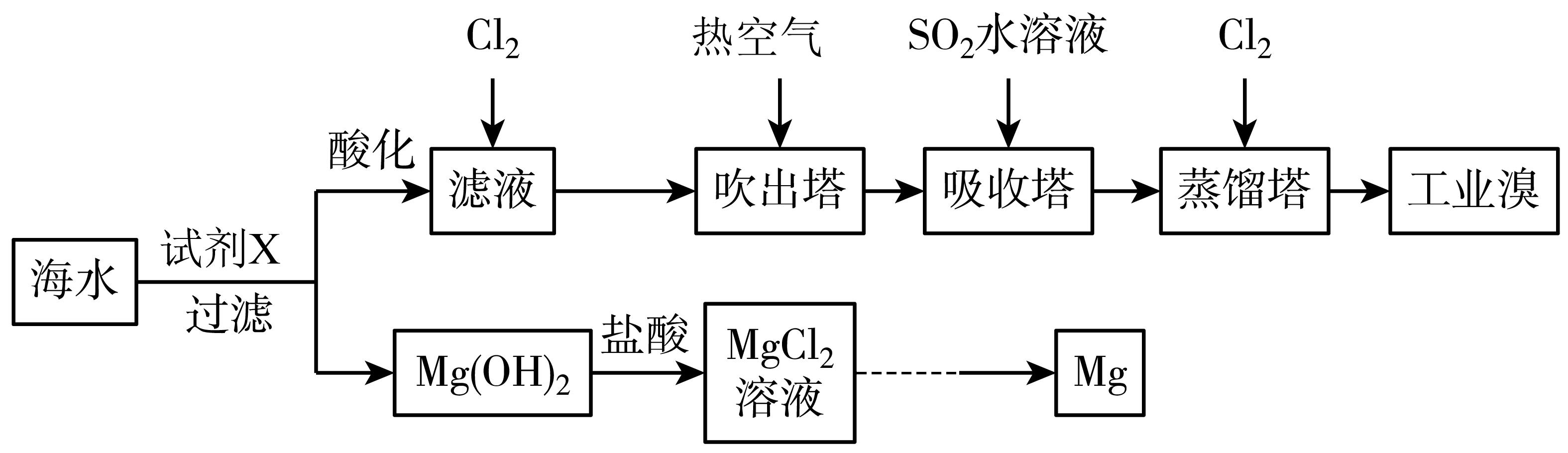
试剂$\\text{X}$可以选用石灰乳
","工业上常利用电解$\\text{MgC}{{\\text{l}}_{2}}$溶液冶炼金属镁
","若提取$\\rm 1\\;\\rm mol\\text{ B}{{\\text{r}}_{2}}$,至少需要标准状况下$\\rm 44.8\\;\\rm L$的$\\text{C}{{\\text{l}}_{2}}$
","吸收塔中发生反应的离子方程式为$\\text{B}{{\\text{r}}_{2}}+\\text{S}{{\\text{O}}_{2}}+2{{\\text{H}}_{2}}\\text{O}=2\\text{B}{{\\text{r}}^{-}}+\\text{SO}_{4}^{2-}+4{{\\text{H}}^{+}}$
"]海水中加石灰乳可将镁离子转化为氢氧化镁沉淀,过滤后将氢氧化镁溶于盐酸得到氯化镁溶液,再经浓缩结晶、$\rm HCl$氛围脱水、熔融电解得到$\rm Mg$;海水加石灰乳过滤得到滤液,滤液酸化后通入氯气生成溴单质,用热空气吹出溴单质,用二氧化硫水溶液吸收溴单质,再在蒸馏塔中通氯气,将$\rm HBr$氧化生成溴单质,然后蒸馏得到溴,据此分析解答。
$\rm A$.由以上分析可知沉淀剂选用石灰乳,经济廉价,故$\rm A$正确;
$\rm B$.工业上常利用电解熔融$\text{MgC}{{\text{l}}_{2}}$得到镁单质,故$\rm B$错误;
$\rm C$.氯气在过程中发生反应:$\text{2B}{{\text{r}}^{-}}\text{+C}{{\text{l}}_{2}}=\text{B}{{\text{r}}_{2}}+2\text{C}{{\text{l}}^{-}}$,由上述分析可知生成$\rm 1\;\rm mol\text{ B}{{\text{r}}_{2}}$,需发生两次上述反应,则消耗$\rm 2\;\rm mol\text{ C}{{\text{l}}_{2}}$,需要标准状况下$\rm 44.8\;\rm L$的$\text{C}{{\text{l}}_{2}}$,故$\rm C$正确;
$\rm D$.由上述分析可知吸收塔中二氧化硫和溴单质反应生成硫酸和$\rm HBr$,发生反应的离子方程式为$\text{B}{{\text{r}}_{2}}+\text{S}{{\text{O}}_{2}}+2{{\text{H}}_{2}}\text{O}=2\text{B}{{\text{r}}^{-}}+\text{SO}_{4}^{2-}+4{{\text{H}}^{+}}$,故$\rm D$正确。
故选:$\rm B$
高中 | 氯气题目答案及解析(完整版)
