高中 | 氧化还原反应方程式的书写及配平 题目答案及解析
稿件来源:高途
高中 | 氧化还原反应方程式的书写及配平题目答案及解析如下,仅供参考!
必修一
第二章 化学物质及其变化
第三节 氧化还原反应
氧化还原反应方程式的书写及配平
$\text{S}{{\text{O}}_{2}}$在生活、生产中有重要用途,使用不当会造成环境污染。
某同学利用如图所示装置研究二氧化硫的性质。
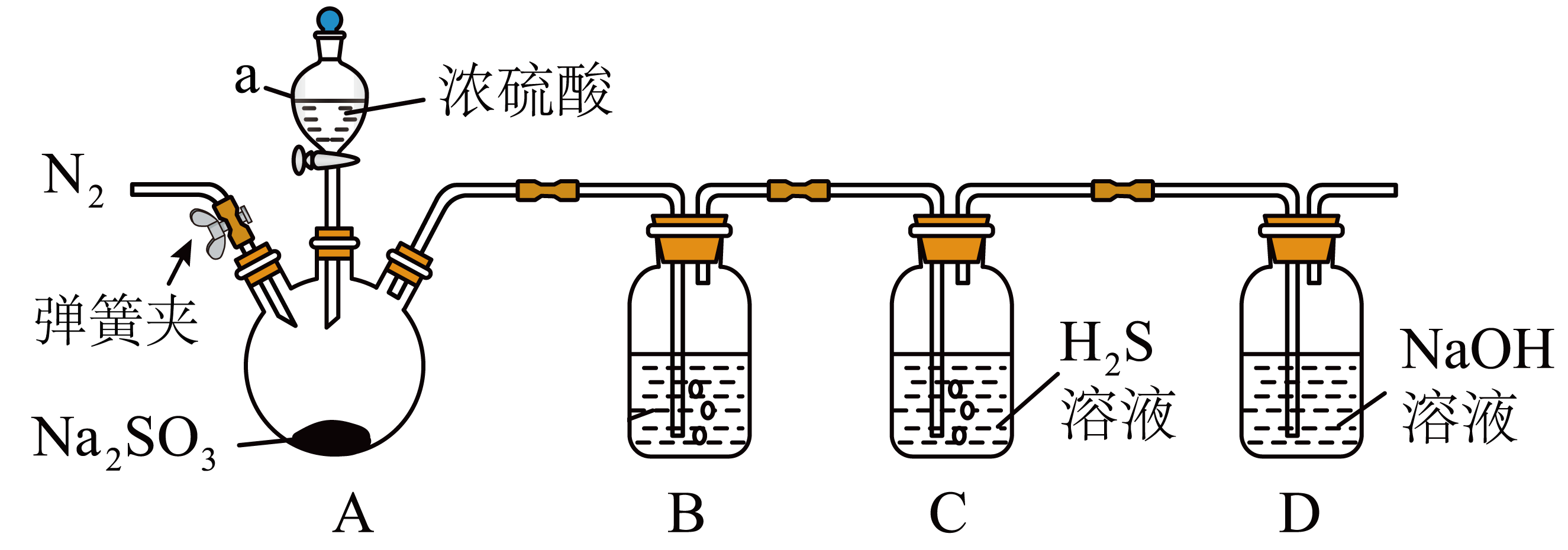
①向仪器$\rm a$中滴加浓硫酸之前,需先通入一段时间$\rm {{\text{N}}_{2}}$,此操作的目的是 。
②若溶液$\rm B$为下列溶液,其中通入$\rm \text{S}{{\text{O}}_{2}}$一定不会产生沉淀的是 。
$\rm A$.$\rm \text{Ba}{{(\text{OH})}_{2}}$ $\rm B$.$\rm \text{Ba}{{\left( \text{N}{{\text{O}}_{3}} \right)}_{2}}$ $\rm C$.$\rm \text{Ca}{{(\text{ClO})}_{2}}$ $\rm D$.$\rm \text{BaC}{{\text{l}}_{2}}$
③装置$\rm C$中产生了浑浊,$\rm C$中的反应消耗氧化剂与还原剂的物质的量之比为 。
除去装置内的空气,防止氧气干扰实验;$\\rm D$;$\\rm 1: 2$
"]]①$\rm SO_{2}$和水反应生成$\rm H_{2}SO_{3}$,易被空气中的$\rm O_{2}$氧化为$\rm H_{2}SO_{4}$,故加入浓硫酸之前,要先通入一段时间$\rm N_{2}$,将装置中的空气排尽,排除空气的干扰;
②$\rm A$.$\rm \text{Ba}{{(\text{OH})}_{2}}$和少量$\rm SO_{2}$反应生成$\rm BaSO_{3}$沉淀,不符合题意;
$\rm B$.$\rm \text{Ba}{{\left( \text{N}{{\text{O}}_{3}} \right)}_{2}}$和$\rm SO_{2}$发生氧化还原反应生成$\rm BaSO_{4}$沉淀,不符合题意;
$\rm C$.$\rm \text{Ca}{{(\text{ClO})}_{2}}$和$\rm SO_{2}$发生氧化还原反应生成$\rm CaSO_{4}$沉淀,不符合题意;
$\rm D$.盐酸的酸性强于亚硫酸,故$\rm \text{BaC}{{\text{l}}_{2}}$和$\rm SO_{2}$不反应,符合题意;
故选:$\rm D$。
③装置$\rm C$中产生了浑浊,发生了反应$\rm SO_{2}+2H_{2}S=3S+2H_{2}O$,氧化剂为$\rm SO_{2}$,还原剂为$\rm H_{2}S$,故氧化剂与还原剂的物质的量之比为$\rm 1:2$。
某化工厂用如图所示工艺流程除去燃煤产生的$\text{S}{{\text{O}}_{2}}$。
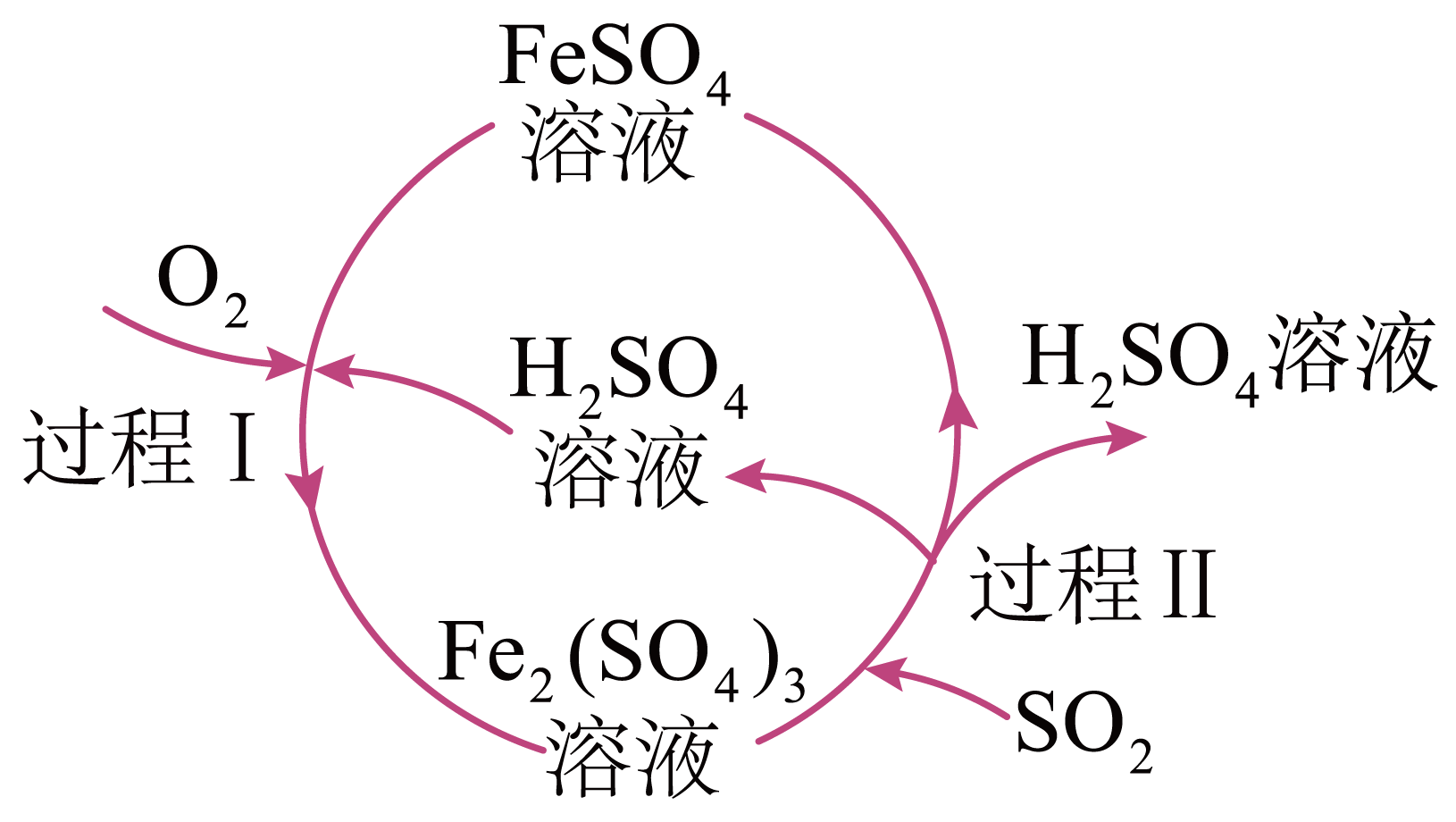
①写出在催化剂条件下总反应的化学方程式 。
②过程Ⅱ发生反应的离子方程式为 。
$2\\text{S}{{\\text{O}}_{2}}+{{\\text{O}}_{2}}+2{{\\text{H}}_{2}}\\text{O}\\begin{matrix} \\underline{\\underline{催化剂}} \\\\ {} \\\\ \\end{matrix}2{{\\text{H}}_{2}}\\text{S}{{\\text{O}}_{4}}$;$2 \\mathrm{Fe}^{3+}+\\mathrm{SO}_{2}+2 \\mathrm{H}_{2} \\mathrm{O}=2 \\mathrm{Fe}^{2+}+\\mathrm{SO}_{4}^{2-}+4 \\mathrm{H}^{+}$
"]]①结合流程图示和分析知,在催化剂条件下总反应的化学方程式为$\rm 2SO_{2}+O_{2}+2H_{2}O\begin{align} & \underline{\underline{催化剂}} \\ & \\ \end{align}\rm 2H_{2}SO_{4}$;
②过程$\rm II$中$\rm SO_{2}$与$\rm Fe_{2}(SO_{4})_{3}$溶液反应生成$\rm FeSO_{4}$、$\rm H_{2}SO_{4}$,反应的化学方程式为$\rm SO_{2}+Fe_{2}(SO_{4})_{3}+2H_{2}O=2FeSO_{4}+2H_{2}SO_{4}$,离子方程式为$\rm SO_{2}+2Fe^{3+}+2H_{2}O=2Fe^{2+}+\text{SO}_{\text{4}}^{{2-}}\rm +4H^{+}$。
电化学法处理$\text{S}{{\text{O}}_{2}}$是目前研究的热点。利用过氧化氢吸收$\text{S}{{\text{O}}_{2}}$可消除$\text{S}{{\text{O}}_{2}}$污染,设计装置如图所示。
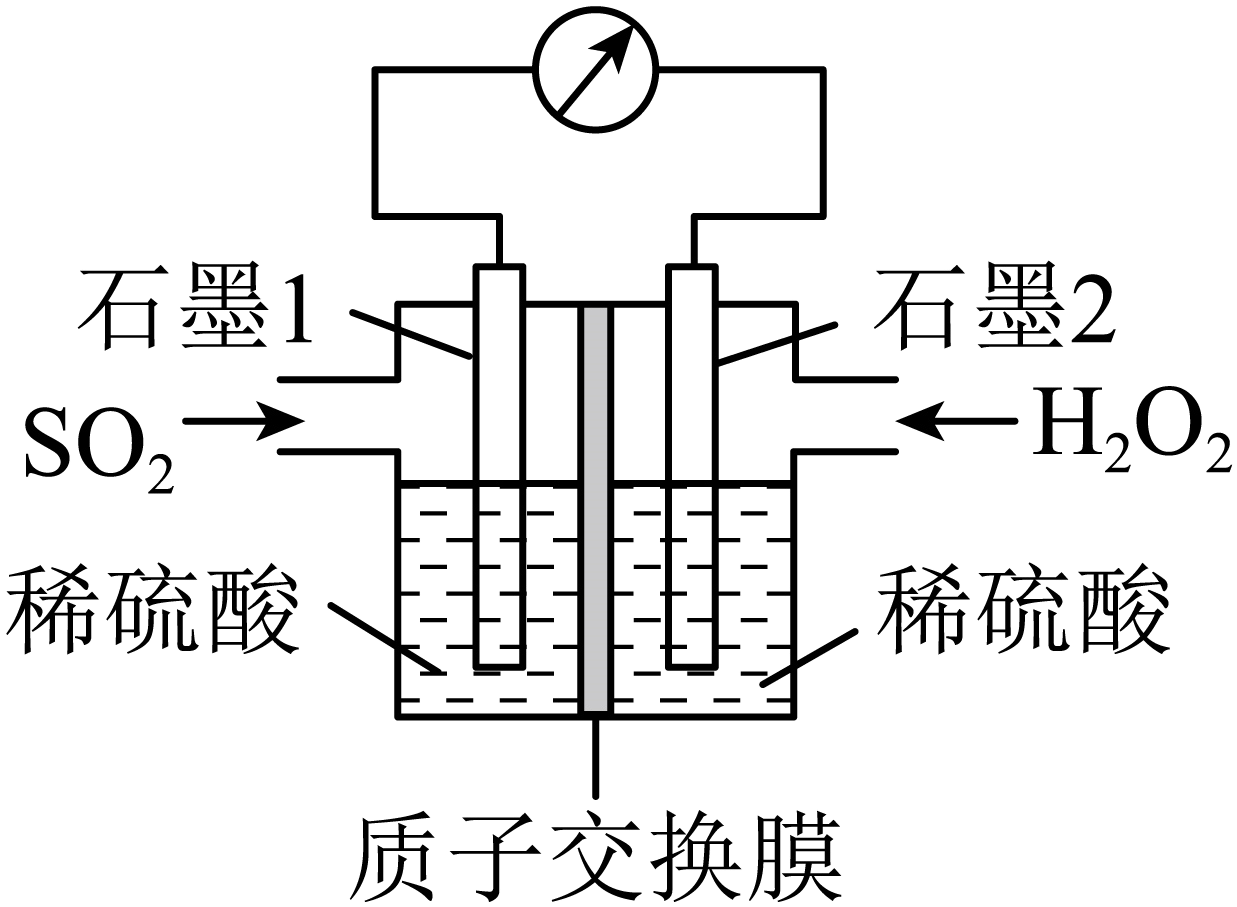
①石墨$\rm 1$电极处发生的电极反应式为 。
②若$\rm 11.2\;\rm L($标准状况$\rm )\text{S}{{\text{O}}_{2}}$参与反应,则电路中转移电子的物质的量为 。
$\\rm {S}{{{O}}_{2}}-2{{{e}}^{-}}+2{{{H}}_{2}}{O}={SO}_{4}^{2-}+4{{{H}}^{+}}$;$\\rm 1\\;\\rm mol$
"]]①过氧化氢吸收$\rm SO_{2}$,两者发生反应:$\rm {{{H}}_{{2}}}{{{O}}_{{2}}}{+S}{{{O}}_{{2}}}={{{H}}_{{2}}}{S}{{{O}}_{4}}$,$\rm SO_{2}$在石墨$\rm 1$上失电子,发生反应:$\rm {S}{{{O}}_{{2}}}{+2}{{{H}}_{2}}{O-2}{{{e}}^{-}}{=SO}_{{4}}^{{2-}}+4{{{H}}^{+}}$,石墨$\rm 1$作负极;石墨$\rm 2$作正极,正极反应为:$\rm {{{H}}_{{2}}}{{{O}}_{{2}}}{+2}{{{H}}^{+}}{+2}{{{e}}^{-}}{=2}{{{H}}_{{2}}}{O}$;
②由电极反应可知$\rm 1\;\rm mol\;\rm SO_{2}$反应时转移$\rm 2\;\rm mol$电子,若$\rm 11.2\;\rm L($即$\rm 0.5\;\rm mol)SO_{2}$参与反应时,转移电子的物质的量为$\rm 1\;\rm mol$。
高中 | 氧化还原反应方程式的书写及配平题目答案及解析(完整版)
