高中 | 氧化还原反应方程式的书写及配平 题目答案及解析
稿件来源:高途
高中 | 氧化还原反应方程式的书写及配平题目答案及解析如下,仅供参考!
必修一
第二章 化学物质及其变化
第三节 氧化还原反应
氧化还原反应方程式的书写及配平
科学、安全、有效和合理地开发自然资源,对生产、生活有重要价值。请回答下列问题:
活性炭吸附法是工业提取碘的方法之一,其流程如下:

已知:$\rm pH=2$时,Ⅰ.$\rm NaNO_{2}$溶液只能将$\rm I^{-}$氧化为$\rm I_{2}$,同时生成$\rm NO$
Ⅱ.$\text{2MnO}_{4}^{-}+{{\text{I}}_{\text{2}}}\text{+4}{{\text{H}}^{+}}\text{=2IO}_{3}^{-}\text{+2M}{{\text{n}}^{\text{2+}}}\text{+2}{{\text{H}}_{\text{2}}}\text{O}$
①氧化过程的离子方程式为 。
②根据$\rm I_{2}$的特性,分离操作$\rm X$应为 、冷却结晶。
③酸性$\rm KMnO_{4}$是常用的强氧化剂,但该方法中却选择了价格较高的$\rm NaNO_{2}$,原因是 。
$\\text{2}{{\\text{I}}^{-}}+\\text{2NO}_{2}^{-}+\\text{4}{{\\text{H}}^{+}}={{\\text{I}}_{\\text{2}}}+\\text{2NO}\\uparrow+ \\text{2}{{\\text{H}}_{\\text{2}}}\\text{O}$;升华$\\rm ($或加热$\\rm )$;酸性$\\rm KMnO_{4}$会继续氧化$\\rm I_{2}$
"]]①$\rm pH=2$时,$\rm NaNO_{2}$溶液只能将$\rm I^{-}$氧化为$\rm I_{2}$,同时生成$\rm NO$,$\rm I$元素化合价由$\rm -1$升高为$\rm 0$、$\rm N$元素化合价由$\rm +3$降低为$\rm +2$,根据得失电子守恒,氧化过程的离子方程式为$\text{2}{{\text{I}}^{-}}+\text{2NO}_{2}^{-}+\text{4}{{\text{H}}^{+}}={{\text{I}}_{\text{2}}}+\text{2NO}\uparrow+ \text{2}{{\text{H}}_{\text{2}}}\text{O}$。
②$\rm I_{2}$易升华,根据$\rm I_{2}$的特性,分离操作$\rm X$应为升华、冷却结晶。
③$\rm pH=2$时,$\rm NaNO_{2}$溶液只能将$\rm I^{-}$氧化为$\rm I_{2}$,酸性$\rm KMnO_{4}$是常用的强氧化剂,酸性$\rm KMnO_{4}$会继续把$\rm I_{2}$氧化为$\rm I$的高价化合物,所以该方法中却选择了价格较高的$\rm NaNO_{2}$。
以金红石$\rm ($主要成分为$\rm TiO_{2})$为原料,制取$\rm Ti$的工艺流程如图所示:
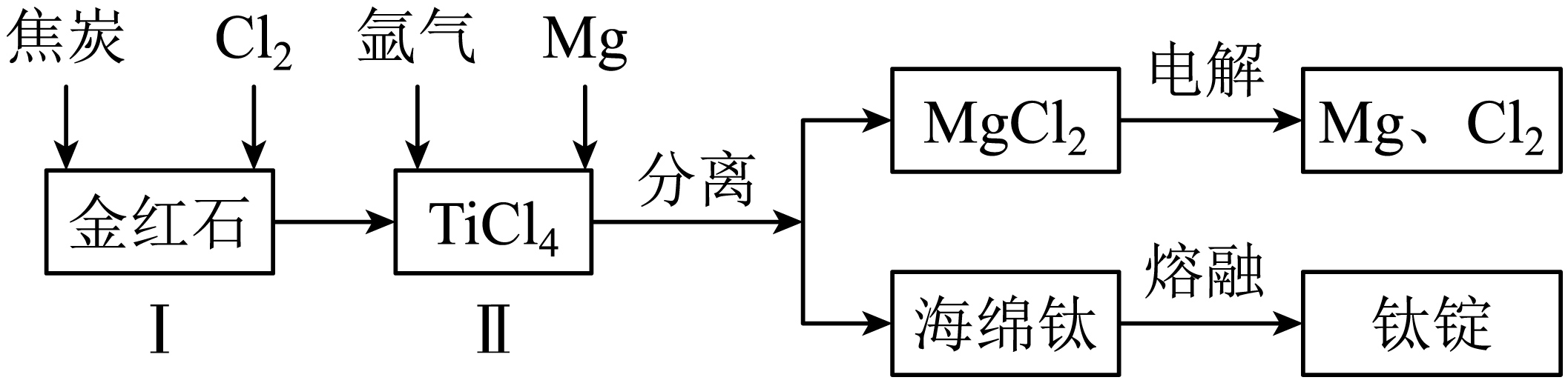
①$\rm I$在高温条件下进行,产物中有一种可燃性无色气体。$\rm I$中反应的化学方程式为 。
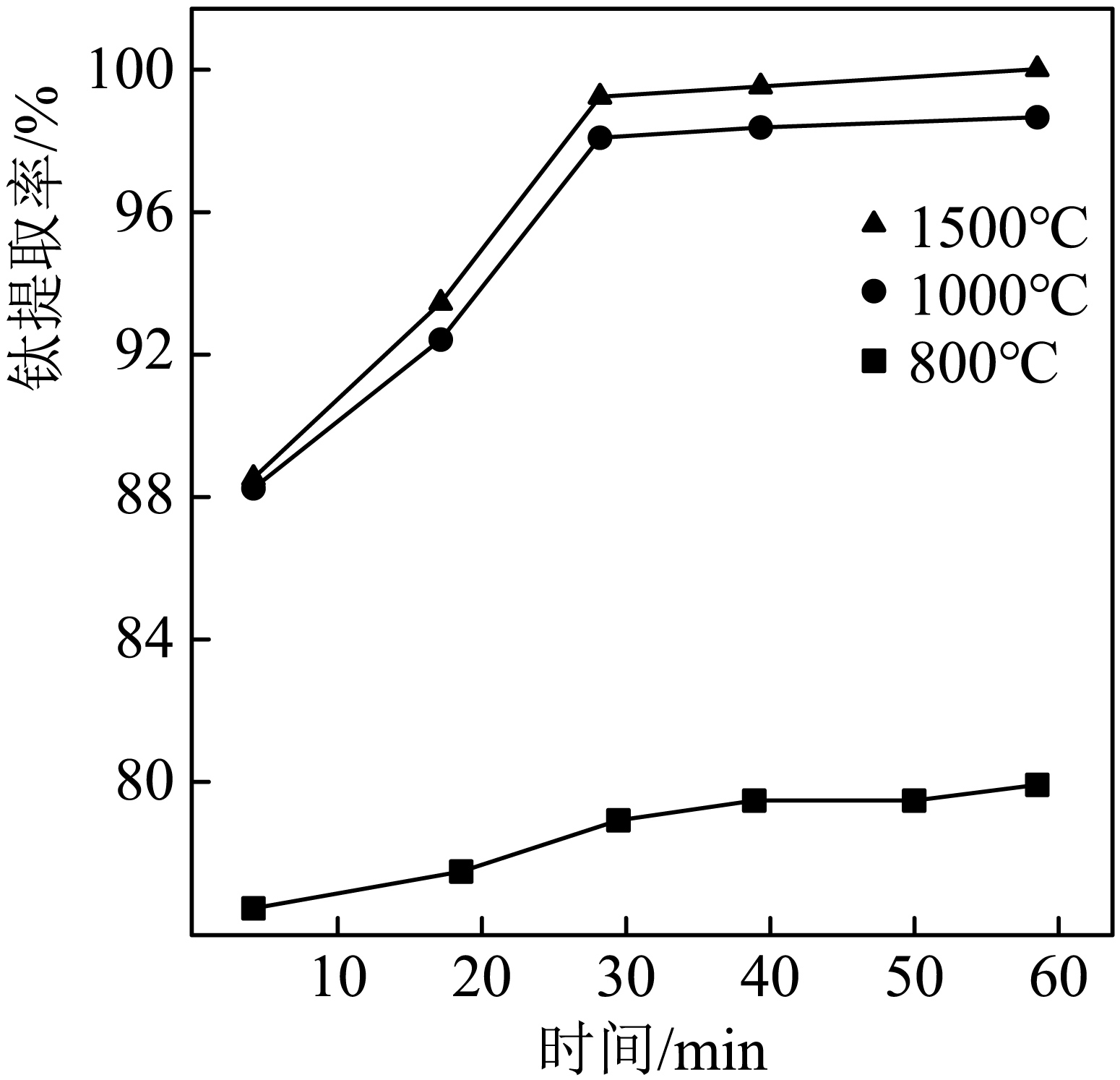
②$\rm II$中钛的提取率在不同温度下随时间变化的曲线如图所示,则反应适宜的温度为 $\rm \;\rm ^\circ\rm C$。
③$\rm II$中氩气的作用是 。
④海绵钛除杂时得到的$\rm MgCl_{2}$可以循环使用,在上述工艺流程中可循环使用的物质还有 $\rm ($填化学式$\rm )$。
$\\rm \\text{Ti}{{\\text{O}}_{\\text{2}}} +2C+2C {{\\text{l}}_{\\text{2}}}\\begin{matrix} \\underline{\\underline{高温}} \\\\ {} \\\\ \\end{matrix}\\text{TiC}{{\\text{l}}_{\\text{4}}}\\text{+2CO}$;$\\rm 1000$;作保护气,防止$\\rm Mg$和$\\rm Ti$被氧化;$\\rm Mg$、$\\rm Cl_{2}$
"]]①$\rm TiO_{2}$、焦炭、氯气在高温条件下进行生成$\rm TiCl_{4}$,产物中有一种可燃性无色气体,该可燃性气体是$\rm CO$,则$\rm I$中反应的化学方程式为$\text{Ti}{{\text{O}}_{\text{2}}}\text{+2C+2C}{{\text{l}}_{\text{2}}}\begin{matrix} \underline{\underline{高温}} \\ {} \\ \end{matrix}\text{TiC}{{\text{l}}_{\text{4}}}\text{+2CO}$。
②根据$\rm II$中钛的提取率在不同温度下随时间变化的曲线,$\rm 800\;\rm ^\circ\rm C$ $\rm Ti$的提取率低,$\rm 1000\;\rm ^\circ\rm C$和$\rm 1500\;\rm ^\circ\rm C$ $\rm Ti$提取率相差不大,从能源消耗的角度,反应适宜的温度为$\rm 1000\;\rm ^\circ\rm C$。
③$\rm II$中氩气的作用是作保护气,防止$\rm Mg$和$\rm Ti$被氧化。
④根据工艺流程,可循环使用的物质还有$\rm Mg$、$\rm Cl_{2}$。
高中 | 氧化还原反应方程式的书写及配平题目答案及解析(完整版)
