高中 | 化学平衡常数 题目答案及解析
稿件来源:高途
高中 | 化学平衡常数题目答案及解析如下,仅供参考!
选修四
第二章 化学反应速率和化学平衡
第三节 化学平衡
化学平衡常数
已知$\rm HF$分子在一定条件下会发生二聚反应:$\text{2HF}\left( \text{g} \right)\rightleftharpoons {{\left( \text{HF} \right)}_{\text{2}}}\left( \text{g} \right)$。经实验测得,不同压强下,体系的平均摩尔质量${\rm (\bar{M}}=\dfrac{{{m}_总}}{{{n}_总}}\rm )$随温度$ (T)$的变化曲线如图所示,下列说法错误的是$(\qquad)$
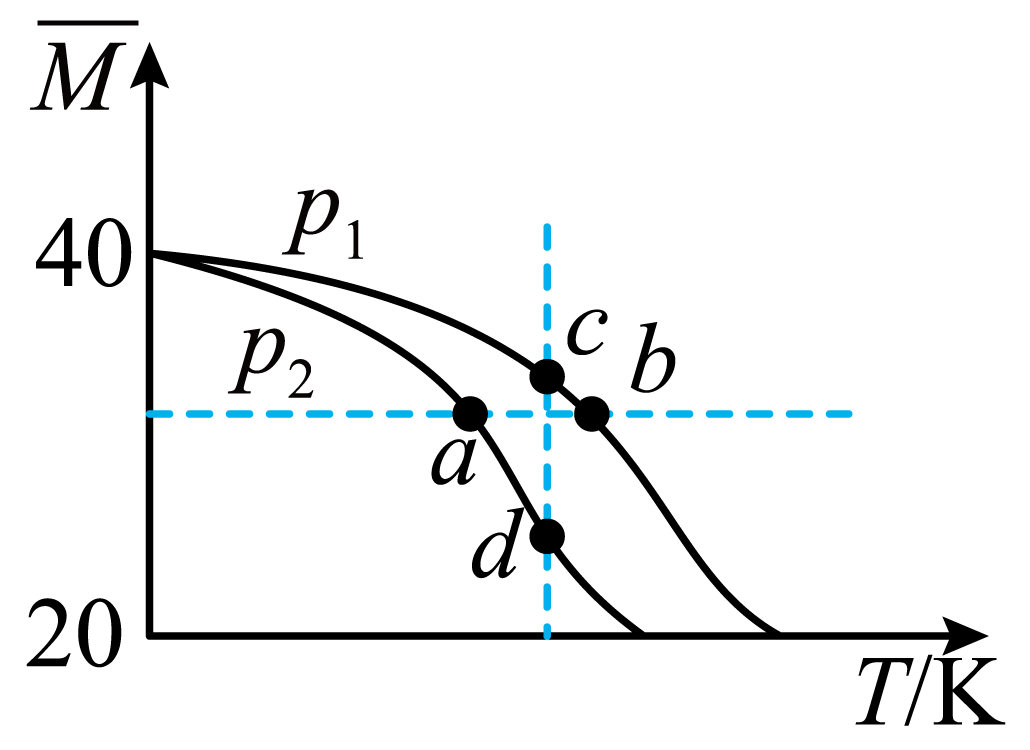
该反应的$\\Delta H\\lt 0$
","平衡常数:$K\\left(\\rm a \\right)\\gt K\\left(\\rm c \\right)\\gt K\\left(\\rm b \\right)$
","${{\\left( \\text{HF} \\right)}_{\\text{2}}}$的体积分数$\\rm c$点比$\\rm d$点大
","测定$\\rm HF$的相对分子质量要在高压、低温条件下
"]$\rm A$.同一压强下,温度升高平均摩尔质量减小,气体质量守恒,物质的量增大,说明平衡向逆反应方向进行,由于升温平衡向吸热反应方向进行,因此正反应是放热反应,$\Delta H\lt 0$,$\rm A$项正确;
$\rm B$.正反应是放热反应,温度越高平衡常数越小,平衡常数:$K\left(\rm a \right)\gt K\left(\rm c \right)\gt K\left(\rm b \right)$,$\rm B$项正确;
$\rm C$.增大压强,平衡向气体分子数减小的方向移动,质量不变的情况下平均摩尔质量增大,因此$\rm c$点压强大于$\rm d$点压强,${{\left( \text{HF} \right)}_{\text{2}}}$的体积分数更大,$\rm C$项正确;
$\rm D$.正反应是气体分子数减小的放热反应,测定$\rm HF$的相对分子质量应使平衡逆向进行,需要在低压、高温条件下进行以提高$\rm HF$的纯度,$\rm D$项错误。
故选:$\rm D$
高中 | 化学平衡常数题目答案及解析(完整版)
