高中 | 氧化还原反应方程式的书写及配平 题目答案及解析
稿件来源:高途
高中 | 氧化还原反应方程式的书写及配平题目答案及解析如下,仅供参考!
必修一
第二章 化学物质及其变化
第三节 氧化还原反应
氧化还原反应方程式的书写及配平
氧化亚铜$\rm (Cu_{2}O)$主要用于制造杀虫剂、分析试剂和红色玻璃等。$\rm Cu_{2}O$在酸性溶液中歧化为二价铜离子和铜单质。以黄铜矿$\rm ($主要成分为$\rm CuFeS_{2}$,含有杂质$\rm SiO_{2})$为原料制取$\rm Cu_{2}O$的一种工艺流程如图:
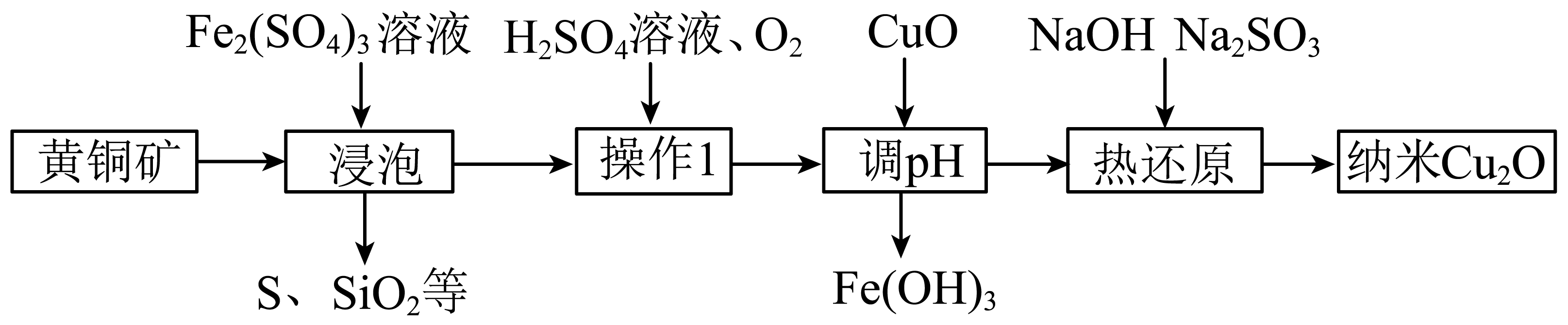
写出“浸泡”时$\rm CuFeS_{2}$发生反应的离子方程式: 。$\rm Cu_{2}O$在酸性溶液中发生歧化反应的离子反应方程式为 。
$\\text{CuFe}{{\\text{S}}_{2}}+4\\text{F}{{\\text{e}}^{3+}}=5\\text{F}{{\\text{e}}^{2+}}+\\text{C}{{\\text{u}}^{2+}}+2\\text{S}$;$\\text{C}{{\\text{u}}_{2}}\\text{O}+2{{\\text{H}}^{+}}=\\text{Cu}+\\text{C}{{\\text{u}}^{2+}}+{{\\text{H}}_{2}}\\text{O}$
"]]由图可知,加入硫酸铁,有硫单质生成,根据氧化还原反应,“浸泡”时$\rm CuFeS_{2}$发生反应的离子方程式:$\text{CuFe}{{\text{S}}_{2}}+4\text{F}{{\text{e}}^{3+}}=5\text{F}{{\text{e}}^{2+}}+\text{C}{{\text{u}}^{2+}}+2\text{S}$,氧化亚铜发生歧化反应,铜元素化合价有升有降,对应的离子方程式为$\text{C}{{\text{u}}_{2}}\text{O}+2{{\text{H}}^{+}}=\text{Cu}+\text{C}{{\text{u}}^{2+}}+{{\text{H}}_{2}}\text{O}$。
判断“操作$\rm 1$”反应已完成的实验操作及现象为 。
取样,滴加铁氰化钾溶液,无蓝色沉淀产生
"]]判断“操作$\rm 1$”反应已完成即不含有二价铁,检验二价铁实验操作及现象为:取样,滴加铁氰化钾溶液,无蓝色沉淀产生。
“热还原”时,将新制$\rm Na_{2}SO_{3}$溶液和$\rm CuSO_{4}$溶液按一定量混合,加热至$\rm 90\;\rm ^\circ\rm C$并不断搅拌反应得到$\rm Cu_{2}O$粉末。制备装置如下图所示:
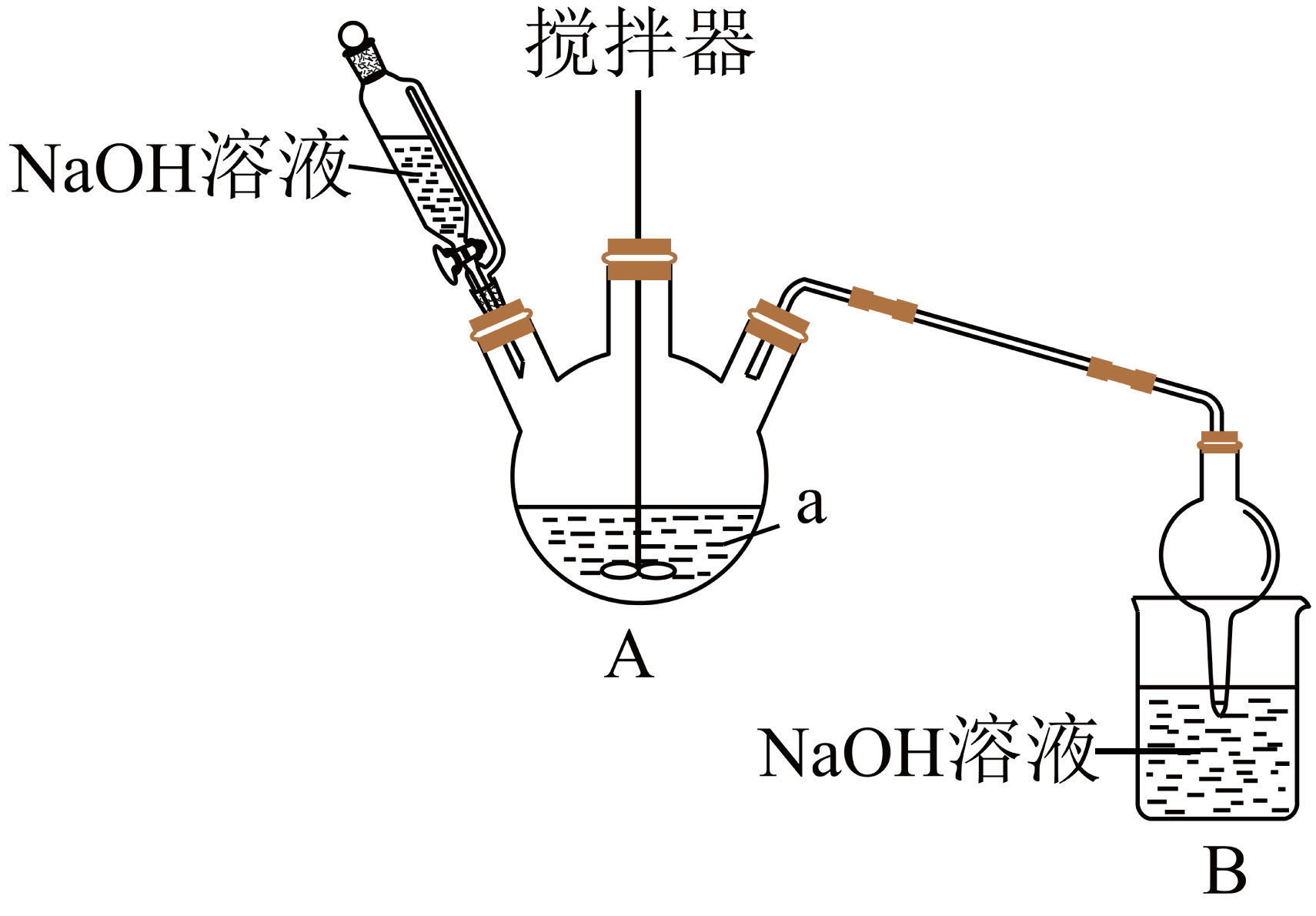
左上方盛放$\rm NaOH$溶液的仪器名称为 ,干燥管的作用是: ,反应时$\rm A$装置原料反应配比为$n\left( \text{N}{{\text{a}}_{2}}\text{S}{{\text{O}}_{3}} \right):n\left( \text{CuS}{{\text{O}}_{4}} \right)=3:2$,$\rm B$装置的作用是吸收反应产生的酸性气体,防止污染环境,$\rm A$装置中反应的化学方程式为 。实际反应中需不断滴加$\rm NaOH$溶液的作用是: 。
恒压分液漏斗;防止倒吸;$3\\text{N}{{\\text{a}}_{2}}\\text{S}{{\\text{O}}_{3}}+2\\text{CuS}{{\\text{O}}_{4}}=\\text{C}{{\\text{u}}_{2}}\\text{O}\\downarrow +3\\text{N}{{\\text{a}}_{2}}\\text{S}{{\\text{O}}_{4}}+2\\text{S}{{\\text{O}}_{2}}\\uparrow $;降低溶液酸性,防止$\\rm Cu_{2}O$在酸性溶液中歧化为二价铜和铜单质
"]]左上方盛放$\rm NaOH$溶液的仪器名称为恒压分液漏斗,因为装置$\rm A$中会产生$\rm SO_{2}$,所以干燥管的作用是防止倒吸,反应时$\rm A$装置原料反应配比为$ {n}\left( \text{N}{{\text{a}}_{2}}\text{S}{{\text{O}}_{3}} \right): {n}\left( \text{CuS}{{\text{O}}_{4}} \right)=3:2$,$\rm B$装置的作用是吸收反应产生的酸性气体,防止污染环境,说明有$\rm SO_{2}$生成,化学方程式为:$3\text{N}{{\text{a}}_{2}}\text{S}{{\text{O}}_{3}}+2\text{CuS}{{\text{O}}_{4}}=\text{C}{{\text{u}}_{2}}\text{O}\downarrow +3\text{N}{{\text{a}}_{2}}\text{S}{{\text{O}}_{4}}+2\text{S}{{\text{O}}_{2}}\uparrow $;不断滴加$\rm NaOH$溶液的作用是因为反应产生$\rm SO_{2}$,导致溶液酸性增强,$\rm Cu_{2}O$在酸性溶液中歧化为二价铜和铜单质从而降低$\rm Cu_{2}O$含量。
反应完成后,利用装置$\rm B$中的溶液$\rm (NaOH$与$\rm Na_{2}SO_{3}$混合溶液$\rm )$可制备$\rm Na_{2}SO_{4}\cdot 10H_{2}O$晶体。请补充完整实验方案,取装置$\rm B$中的溶液, ,洗涤、干燥得$\rm Na_{2}SO_{4}\cdot 10H_{2}O$晶体。$\rm ($已知:室温下,溶液中${{\text{H}}_{2}}\text{S}{{\text{O}}_{3}}$、$\text{HSO}_{3}^{-}$、$\text{SO}_{3}^{2-}$的物质的量分数随$\rm pH$的分布如下图所示;室温下从$\text{N}{{\text{a}}_{2}}\text{S}{{\text{O}}_{4}}$饱和溶液中结晶出$\rm Na_{2}SO_{4}\cdot 10H_{2}O$,实验中须使用的试剂及仪器有:$\rm SO_{2}$、氧气、$\rm pH$计$\rm )$
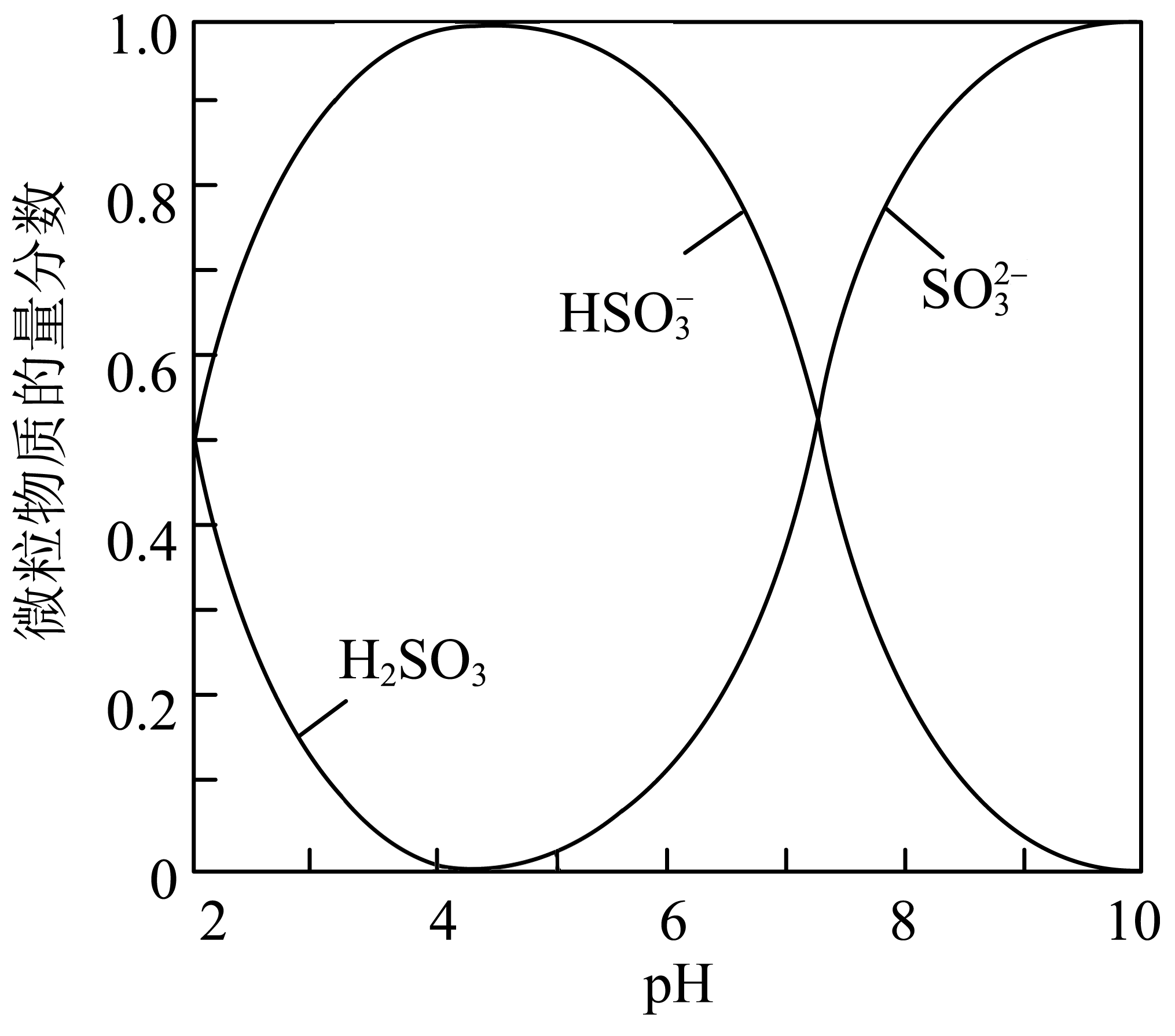
边搅拌边向溶液中通入$\\rm SO_{2}$,用$\\rm pH$计测量溶液的$\\rm pH$,至$\\rm pH$约为$\\rm 10$时,再向溶液中通入$\\rm O_{2}$至$\\rm pH$约为$\\rm 7$,将溶液加热浓缩至有晶膜出现,降温结晶,过滤
"]]若装置$\rm B$中的溶液($\rm NaOH$与$\rm Na_{2}SO_{3}$混合溶液)可制备$\rm Na_{2}SO_{4}\cdot 10H_{2}O$晶体,取装置$\rm B$中的溶液,边搅拌边向溶液中通入$\rm SO_{2}$,用$\rm pH$计测量溶液的$\rm pH$,至$\rm pH$约为$\rm 10$时(由微粒物质的量分数可知$\rm pH$约为$\rm 10$,主要以亚硫酸根离子存在);再向溶液中通入$\rm O_{2}$(将亚硫酸根离子氧化为硫酸根离子)至$\rm pH$约为$\rm 7$,将溶液加热浓缩至有晶膜出现,降温结晶,过滤,洗涤、干燥得$\rm Na_{2}SO_{4}\cdot 10H_{2}O$晶体。
高中 | 氧化还原反应方程式的书写及配平题目答案及解析(完整版)
