高中 | 盖斯定律 题目答案及解析
稿件来源:高途
高中 | 盖斯定律题目答案及解析如下,仅供参考!
选修四
第一章 化学反应与能量
第三节 化学反应热的计算
盖斯定律
根据如图分析,下列说法不正确的是$(\qquad)$
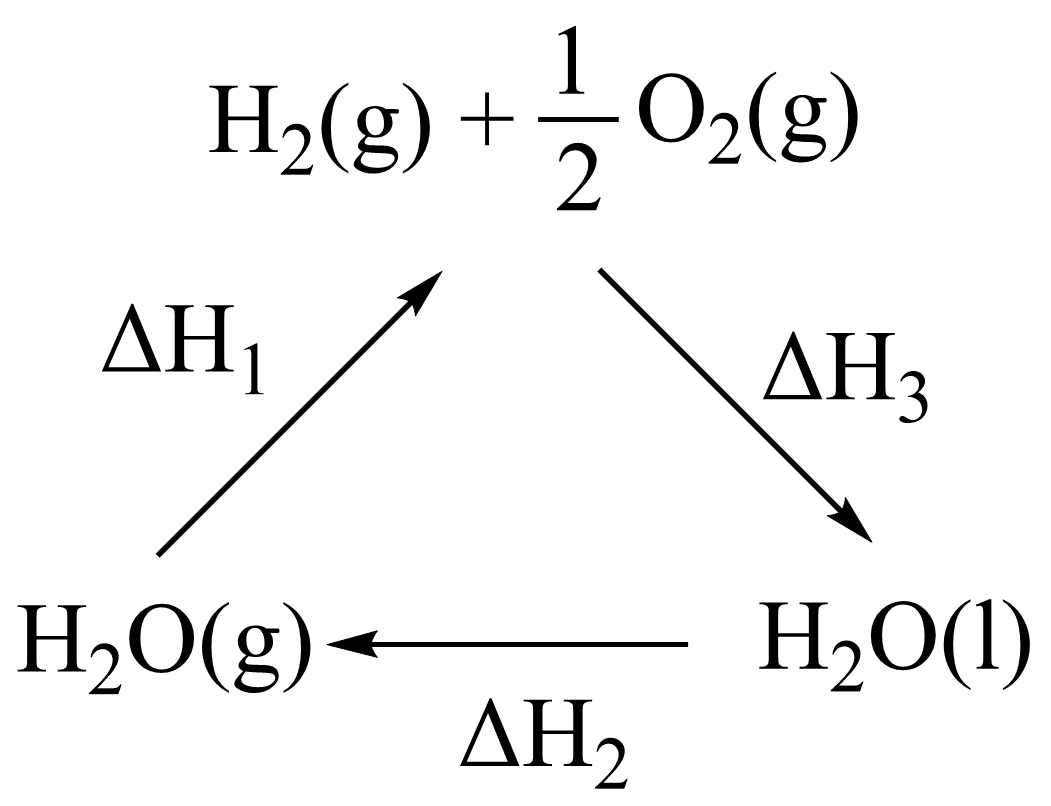
$\\Delta H_{3}\\lt 0$
","$\\rm 1\\;\\rm mol{{\\text{ H}}_{2}}\\text{O}\\left( \\text{g} \\right)$能量高于$\\rm 1\\;\\rm mol{{\\text{ H}}_{2}}\\text{O}\\left( \\text{l} \\right)$
","$\\Delta {{H}_{1}}=\\Delta {{H}_{2}}+\\Delta {{H}_{3}}$
","常温下反应$2{{\\text{H}}_{2}}\\text{O}\\left( \\text{g} \\right)=2{{\\text{H}}_{2}}\\left( \\text{g} \\right)+{{\\text{O}}_{2}}\\left( \\text{g} \\right)$的化学平衡常数的数值很小
"]$\rm A$.$\rm H_{2}$和$\rm O_{2}$反应生成液态水的过程中放热,$\Delta {{ {H}}_{\text{3}}}\lt 0$,$\rm A$正确;
$\rm B$.${{\text{H}}_{2}}\text{O}\left( \text{g} \right)$转化为${{\text{H}}_{2}}\text{O}\left( \text{l} \right)$会放出热量,则$\rm 1\;\rm mol{{\text{ H}}_{2}}\text{O}\left( \text{g} \right)$能量高于$\rm 1\;\rm mol$,$\rm B$正确;
$\rm C$.由图可知,${{\text{H}}_{2}}\text{O}\left( \text{g} \right)={{\text{H}}_{2}}\left( \text{g} \right)+\dfrac{\text{1}}{\text{2}}{{\text{O}}_{2}}\left( \text{g} \right)\qquad \Delta{{ {H}}_{\text{1}}}$,${{\text{H}}_{2}}\left( \text{g} \right)+\dfrac{\text{1}}{\text{2}}{{\text{O}}_{2}}\left( \text{g} \right)={{\text{H}}_{2}}\text{O}\left( \text{l} \right)\qquad \Delta{{H}_{3}}$,${{\text{H}}_{2}}\text{O}\left( \text{l} \right)={{\text{H}}_{2}}\text{O}\left( \text{g} \right)\qquad \Delta{{H}_{2}}$,由盖斯定律可知,$-\Delta {{H}_{1}}=\Delta {{H}_{2}}+\Delta {{H}_{3}}$,$\rm C$错误;
$\rm D$.常温下$\rm H_{2}O(g)$很难分解为$\rm H_{2}(g)$和$\rm O_{2}(g)$,反应$2{{\text{H}}_{2}}\text{O}\left( \text{g} \right)=2{{\text{H}}_{2}}\left( \text{g} \right)+{{\text{O}}_{2}}\left( \text{g} \right)$的化学平衡常数的数值很小,$\rm D$正确。
故选:$\rm C$
高中 | 盖斯定律题目答案及解析(完整版)
