高中 | 化学平衡常数 题目答案及解析
稿件来源:高途
高中 | 化学平衡常数题目答案及解析如下,仅供参考!
选修四
第二章 化学反应速率和化学平衡
第三节 化学平衡
化学平衡常数
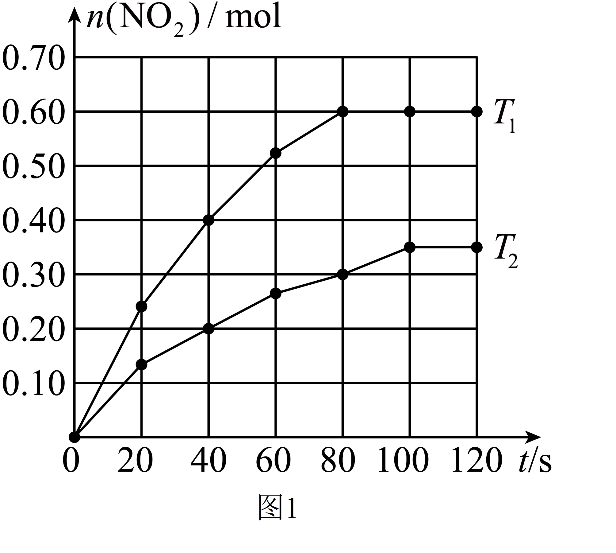
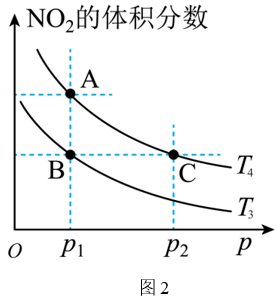
将$\rm 0.4\;\rm mol{{\text{ N}}_{2}}{{\text{O}}_{4}}$气体充入某密闭容器中发生反应:${{\text{N}}_{2}}{{\text{O}}_{4}}\left( \text{g} \right)\rightleftharpoons 2\text{N}{{\text{O}}_{2}}\left( \text{g} \right)\qquad\Delta H$。温度为${{T}_{1}}$和${{T}_{2}}$时,在体积为$\rm 2\;\rm L$的恒容容器中,测得$\text{N}{{\text{O}}_{2}}$的物质的量随时间变化的曲线如图$\rm 1$所示;在温度为${{T}_{3}}$和${{T}_{4}}$时,平衡体系中$\text{N}{{\text{O}}_{2}}$的体积分数随压强变化的曲线如图$\rm 2$所示。
回答下列问题:
由图可知,${{T}_{1}}$ ${{T}_{2}}\rm ($填“$\rm \gt $”“$\rm \lt $”“$\rm =$”或“无法判断”$\rm )$,$\Delta H$ $\rm 0($填“$\rm \gt $”“$\rm \lt $”“$\rm =$”或“无法判断”$\rm )$。
$\\rm \\gt $;$\\rm \\gt $
"]]根据图象曲线变化可知,$T_{1}\;^\circ\rm C$时反应先达到平衡,$T_{1}\;^\circ\rm C$时反应速率大于$T_{2}\;^\circ\rm C$,则温度大小为:${T_{1}\;^\circ\rm C}\gt T_{2}\;^\circ\rm C$,而在$T_{1}\;^\circ\rm C$达到平衡时二氧化氮的物质的量大于$T_{2}\;^\circ\rm C$,说明升高温度,平衡向着正向移动,则该反应为吸热反应,$\Delta H\rm \gt 0$。
${{T}_{1}}$时,$\rm 40\sim 80\;s$内用$\text{N}{{\text{O}}_{2}}$表示的平均反应速率为 。
$\\rm 0.0025\\;\\rm mol/(L·s)$
"]]${{ {T}}_{\text{1}}}$时,$\rm 40\sim 80\;s$内用$\text{N}{{\text{O}}_{2}}$表示的平均反应速率为$\dfrac{\text{0}\text{.6 mol}-0\text{.4 mol}}{\text{2\;\rm L}\times \text{40 s}}\rm =0.0025\;\rm mol/(L·s)$。
$\rm A$、$\rm C$两点的反应速率:$\rm A$ $\rm C($填“$\rm \gt $”“$\rm \lt $”“$\rm =$”或“无法判断”$\rm )$。
$\\rm \\lt $
"]]由图可知,$\rm A$、$\rm C$两点平衡时温度相同,$\rm C$点对应的压强大,反应速率大,$\rm A$、$\rm C$两点的反应速率:$\rm A\lt C$。
由$\rm A$点到$\rm B$点可采取的方法是 ,由$\rm A$点到$\rm C$点可观察到的实验现象是 。
降低温度;容器中气体颜色变深
"]]反应${{\text{N}}_{2}}{{\text{O}}_{4}}\left( \text{g} \right)\rightleftharpoons 2\text{N}{{\text{O}}_{2}}\left( \text{g} \right)$的正反应为吸热反应,温度升高,平衡向正反应方向移动,$\rm NO_{2}$的体积分数增大,由图可知:$\rm AB$两点平衡时压强相同,温度不同,$\rm A$点$\rm NO_{2}$的体积分数大于$\rm B$点$\rm NO_{2}$的体积分数,故$T_{4}\gt T_{3}$,由$\rm A$点到$\rm B$点可采取的方法是降低温度,由$\rm A$点到$\rm C$点压强增大,$\rm NO_{2}$的浓度增大,可观察到的实验现象是:容器中气体颜色变深。
已知$\rm A$点$\text{N}{{\text{O}}_{2}}$的体积分数是$\rm B$、$\rm C$点的$\rm 2$倍,其数值为$\rm 0.5$,则$\rm A$、$\rm B$、$\rm C$三点的平衡常数大小关系为 。
$K_{\\rm A}=K_{\\rm C}\\gt K_{\\rm B}$
"]]$\rm A$、$\rm C$两点为相同温度不同压强下的平衡,故化学平衡常数相等,$\rm B$点温度低于$\rm A$,$\rm C$两点,该反应正反应为吸热反应,则降低温度,$K$减小,则三点平衡常数大小关系为$K_{\rm A}=K_{\rm C}\gt K_{\rm B}$。
高中 | 化学平衡常数题目答案及解析(完整版)
