高中 | 氧化还原反应方程式的书写及配平 题目答案及解析
稿件来源:高途
高中 | 氧化还原反应方程式的书写及配平题目答案及解析如下,仅供参考!
必修一
第二章 化学物质及其变化
第三节 氧化还原反应
氧化还原反应方程式的书写及配平
某校化学小组探究酸性$\text{KMn}{{\text{O}}_{4}}$溶液与${{\text{H}}_{2}}{{\text{O}}_{2}}$溶液反应速率的影响因素。
邹邹进行了实验Ⅰ:常温下,向$\rm 4\;\rm mL$不同浓度的${{\text{H}}_{2}}{{\text{O}}_{2}}$溶液中滴入$\rm 1$滴$\rm (0.04\;\rm mL)0.05\;\rm \text{mol}\cdot {{\text{L}}^{-1}}\text{ KMn}{{\text{O}}_{4}}$溶液$\left[ c\left( {{\text{H}}^{+}} \right)=5.0\;\rm \text{mol}\cdot {{\text{L}}^{-1}} \right]$,记录如下:
| $c\left( {{\text{H}}_{2}}{{\text{O}}_{2}} \right)\rm /(\mathrm{mol} \cdot \mathrm{L}^{-1}\rm )$ | $\rm 0.0013$ | $\rm 0.0015$ | $\rm 0.0125$ | $\rm 0.0312$ | $\rm 0.0440$ | $\rm 0.0620$ |
| 完全褪色时间$\rm /s$ | $\rm 25$ | $\rm 15$ | $\rm 12$ | $\rm 23$ | $\rm 60$ | $\rm 370$ |
| 无色气体体积 | 一样多 | |||||
①将$\text{KMn}{{\text{O}}_{4}}$溶液调成酸性所用的酸是 $\rm ($填“盐酸”“硫酸”“硝酸”或“都行”$\rm )$,该反应的离子方程式为 。
②对于$c\left( {{\text{H}}_{2}}{{\text{O}}_{2}} \right)$增大引起的速率异常现象,伟伟认为可能是${{\text{H}}_{2}}{{\text{O}}_{2}}$分解造成的,你对此结论的正误判断及理由是 。
③为了解释$c\left( {{\text{H}}_{2}}{{\text{O}}_{2}} \right)$增大到一定浓度后反应速率减小,波波查得了如下资料。资料显示,$c\left( {{\text{H}}_{2}}{{\text{O}}_{2}} \right)\gt 0.02\;\rm \text{mol}\cdot {{\text{L}}^{-1}}$,${{\text{H}}_{2}}{{\text{O}}_{2}}$溶液中存在平衡:$2 \mathrm{H}_2 \mathrm{O}_2 \rightleftharpoons \mathrm{H}_4 \mathrm{O}_4$。请用平衡移动原理解释$c\left( {{\text{H}}_{2}}{{\text{O}}_{2}} \right)=0.0312\;\rm \text{mol}\cdot {{\text{L}}^{-1}}$时反应速率忽然减小的原因: 。
硫酸;$\\rm 5{{\\text{H}}_{2}}{{\\text{O}}_{2}}+2MnO_{4}^{-}+6{{\\text{H}}^{+}}=2M{{n}^{2+}}+5{{\\text{O}}_{2}}\\uparrow +8{{\\text{H}}_{2}}\\text{O}$;错误,向不同浓度的过氧化氢溶液中滴入高锰酸钾溶液不足量,产生的气体一样多,说明过氧化氢浓度增大引起的速率异常现象一定不是过氧化氢分解的缘故;$\\rm {{\\text{H}}_{2}}{{\\text{O}}_{2}}$转化为$\\rm {{\\text{H}}_{4}}{{\\text{O}}_{4}}$,溶液中的过氧化氢浓度减小,导致速率减小
"]]①高锰酸钾作为经常使用的氧化剂,将$\rm \text{KMn}{{\text{O}}_{4}}$溶液调成酸性所用的酸是硫酸,不能使用盐酸和硝酸,因为盐酸易被高锰酸钾氧化,产生氯气,而硝酸自身具有氧化性,对高锰酸钾的氧化性带来干扰。高锰酸钾与过氧化氢反应,高锰酸钾作氧化剂,锰元素化合价降低,还原为$\rm M{{n}^{2+}}$;而双氧水中的氧元素化合价升高,生成$\rm {{\text{O}}_{2}}$。
②根据表中数据分析,$c\left( {{\text{H}}_{2}}{{\text{O}}_{2}} \right)$增大,向不同浓度的过氧化氢溶液中滴入高锰酸钾溶液不足量,产生的气体一样多,说明过氧化氢浓度增大引起的速率异常现象一定不是过氧化氢分解的缘故。
③由于$c\left( {{\text{H}}_{2}}{{\text{O}}_{2}} \right)\gt 0.02\;\rm \text{mol}\cdot {{\text{L}}^{-1}}$,${{\text{H}}_{2}}{{\text{O}}_{2}}$溶液中存在平衡:$2 \mathrm{H}_2 \mathrm{O}_2 \rightleftharpoons \mathrm{H}_4 \mathrm{O}_4$,当$c\left( {{\text{H}}_{2}}{{\text{O}}_{2}} \right)=0.0312\;\rm \text{mol}\cdot {{\text{L}}^{-1}}\gt 0.02\;\rm mol\cdot {{\text{L}}^{-1}}$,${{\text{H}}_{2}}{{\text{O}}_{2}}$转化为${{\text{H}}_{4}}{{\text{O}}_{4}}$,溶液中的过氧化氢浓度减小,导致速率减小。
龙龙继续进行实验Ⅱ,并记录如下:
| 操作 | 现象 | |
| 实验Ⅱ | 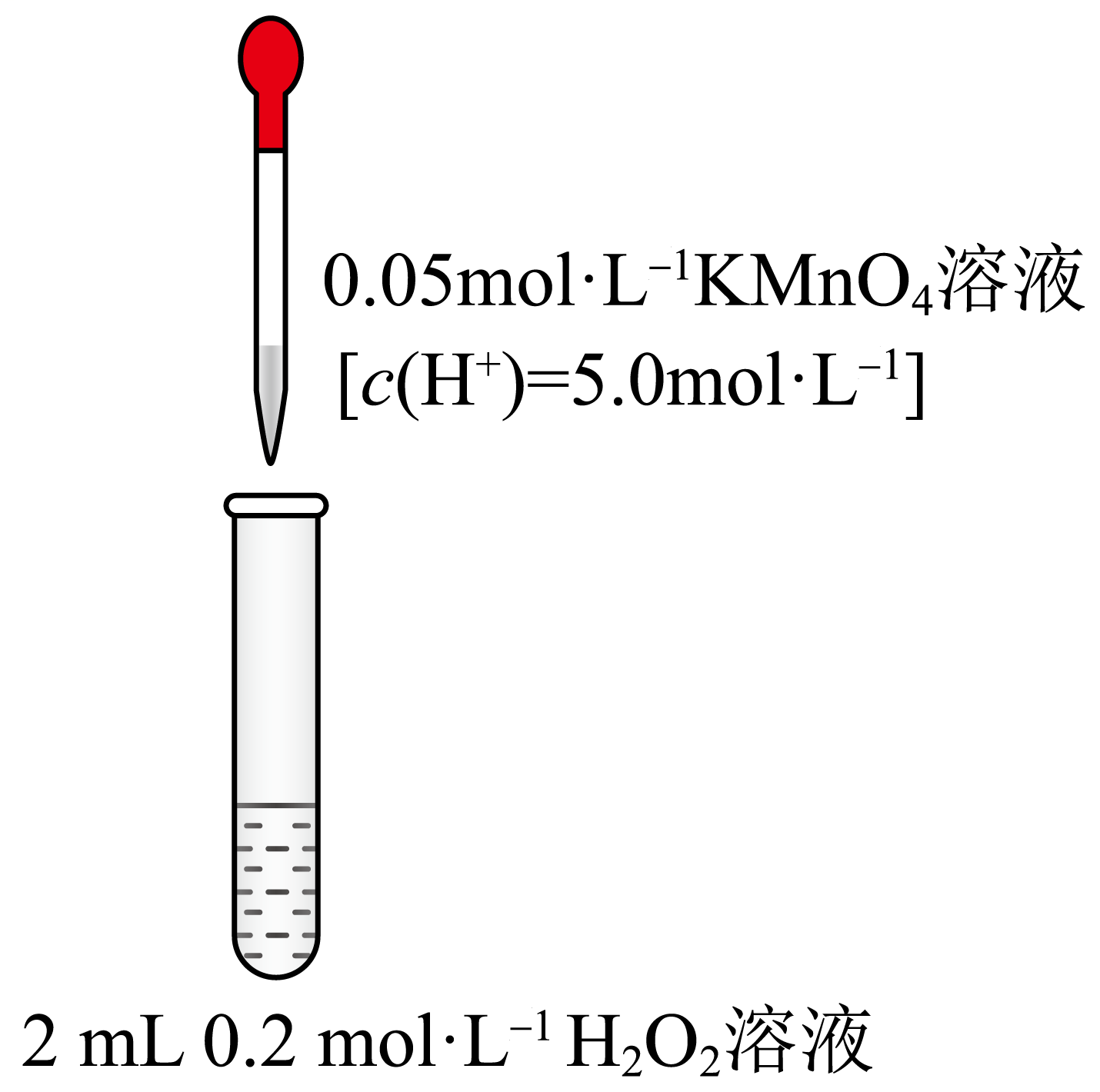 | 第$\rm 1\sim 9$滴溶液滴下,完全褪色所需时间很长;第$\rm 10$滴溶液滴下迅速褪色。整个过程中温度几乎不变 |
①对于第$\rm 10$滴溶液与${{\text{H}}_{2}}{{\text{O}}_{2}}$溶液反应速率剧烈变化的原因,飞飞提出如下假设: 。
②杰杰设计实验方案证实了上述假设合理,请补全他的方案:
| 操作 | 现象 | |
| 实验Ⅲ | 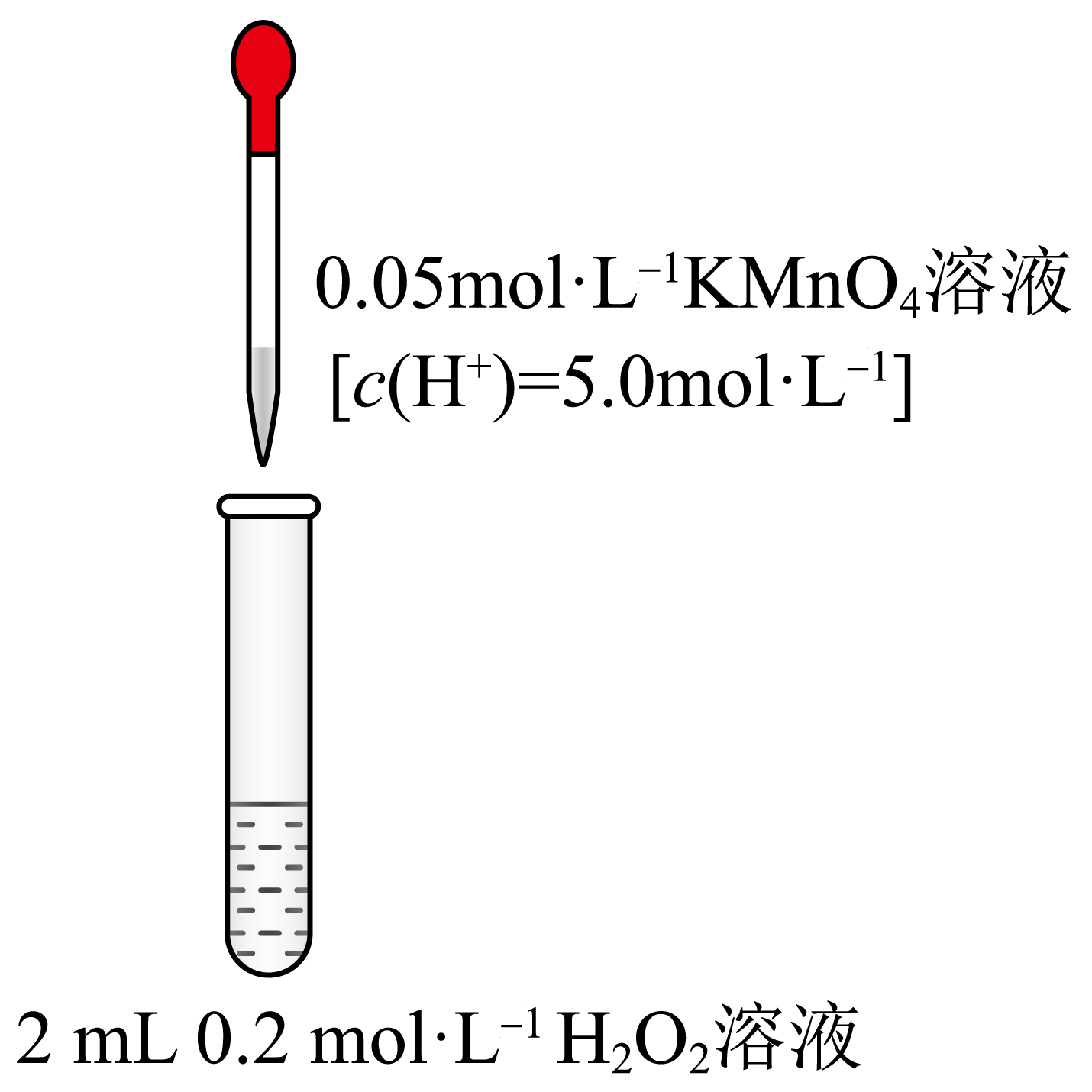 | 滴入$\text{KMn}{{\text{O}}_{4}}$溶液前,先加少量 固体,第$\rm 1\sim 9$滴溶液滴下,完全褪色所需时间大大缩短 |
可能是高锰酸钾与双氧水反应后生成的$\\rm M{{n}^{2+}}$,对双氧水分解起到了催化作用;硫酸锰
"]]①由于第$\rm 10$滴溶液与$\rm {{\text{H}}_{2}}{{\text{O}}_{2}}$溶液反应速率剧烈变化,分析可能是高锰酸钾与双氧水反应后生成的$\rm M{{n}^{2+}}$,对双氧水分解起到了催化作用。
②杰杰设计实验方案证实上述假设合理,因为推测$\rm M{{n}^{2+}}$对双氧水分解起到了催化作用,所以考虑开始就加入少量的硫酸锰固体,以提供$\rm M{{n}^{2+}}$,观察双氧水分解速率情况,验证猜想。
综合上述实验,对于酸性$\text{KMn}{{\text{O}}_{4}}$溶液与${{\text{H}}_{2}}{{\text{O}}_{2}}$溶液反应速率,臧臧进行了总结。下列因素一定能加快反应速率的是 。
$\rm a$.增大$\rm \text{KMn}{{\text{O}}_{4}}$溶液浓度 $\rm b$.增大$\rm {{\text{H}}_{2}}{{\text{O}}_{2}}$溶液浓度
$\rm c$.增大$\rm {{\text{H}}_{2}}\text{S}{{\text{O}}_{4}}$浓度 $\rm d$.适当升高温度
$\rm e$.加入合适的催化剂
$\\rm acde$
"]]$\rm a$.增大$\rm \text{KMn}{{\text{O}}_{4}}$溶液浓度,单位体积内有效碰撞的几率增大,一定能加快反应速率,故$\rm a$正确;
$\rm b$.由题给信息可知,当$c\left( {{\text{H}}_{2}}{{\text{O}}_{2}} \right)\gt 0.02\;\rm \text{mol}\cdot {{\text{L}}^{-1}}$时,${{\text{H}}_{2}}{{\text{O}}_{2}}$转化为${{\text{H}}_{4}}{{\text{O}}_{4}}$,若增大双氧水溶液浓度,会导致更多的${{\text{H}}_{2}}{{\text{O}}_{2}}$转转化为${{\text{H}}_{4}}{{\text{O}}_{4}}$,不一定能加快反应速率,故$\rm b$错误;
$\rm c$.增大$\rm {{\text{H}}_{2}}S{{O}_{4}}$浓度,${c}\left( {{\text{H}}^{+}} \right)$增大,$\rm KMn{{O}_{4}}$的氧化性增强,一定能加快反应速率,故$\rm c$正确;
$\rm d$.加热适当温度,反应的活化分子数增多,一定能加快反应速率,故$\rm d$正确;
$\rm e$.加入合适的催化剂,降低反应活化能,反应的活化分子数和百分数均增多,一定能加快反应速率,故$\rm e$正确;
故答案为:$\rm acde$。
高中 | 氧化还原反应方程式的书写及配平题目答案及解析(完整版)
