高中 | 化学平衡常数 题目答案及解析
稿件来源:高途
高中 | 化学平衡常数题目答案及解析如下,仅供参考!
选修四
第二章 化学反应速率和化学平衡
第三节 化学平衡
化学平衡常数
“低碳经济”备受关注,研究和深度开发$\text{C}{{\text{O}}_{2}}$的应用对构建生态文明社会具有重要的意义。
$\text{Ti}{{\text{O}}_{2}}$是一种性能优良的光催化剂,能有效地将有机污染物转化为$\text{C}{{\text{O}}_{2}}$等小分子物质。下图为在$\text{Ti}{{\text{O}}_{2}}$的催化下,${{\text{O}}_{3}}$降解$\text{C}{{\text{H}}_{3}}\text{CHO}$的示意图,则该反应的化学方程式为 。
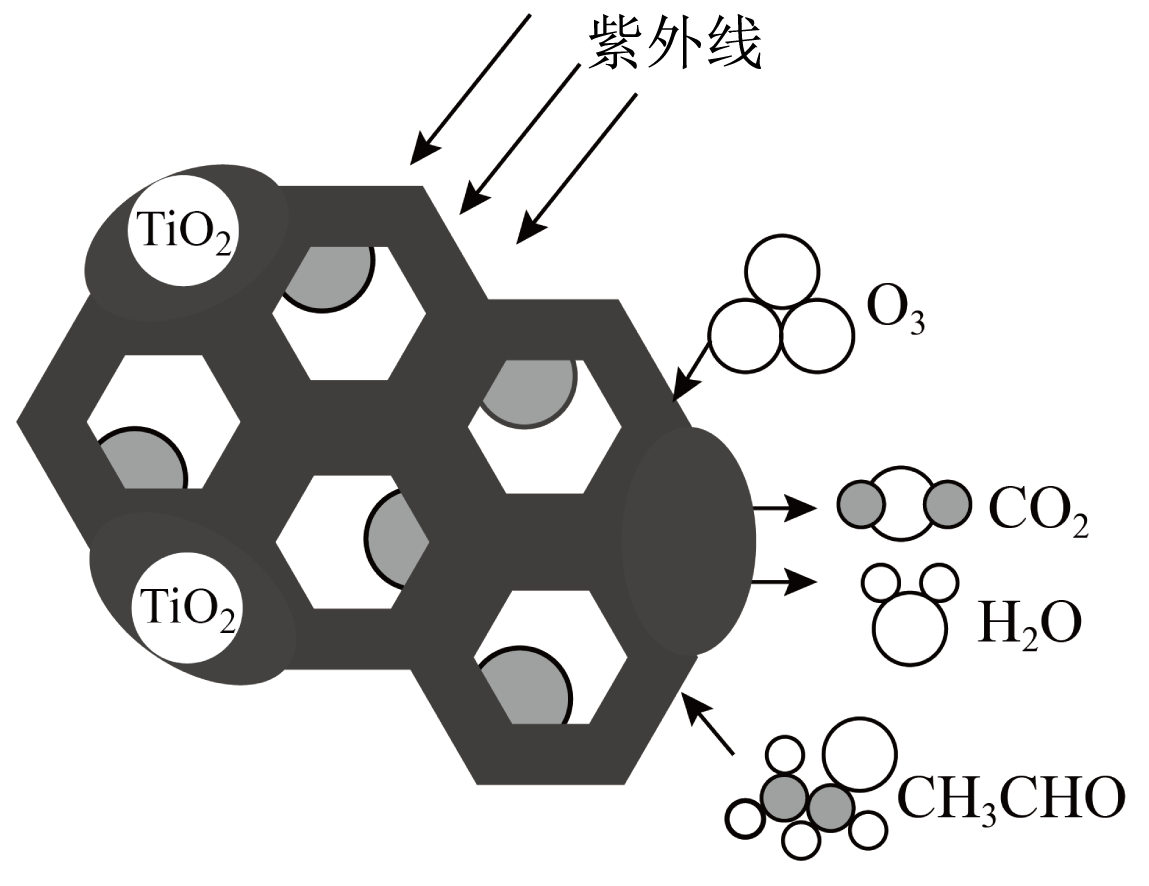
$\\rm 5O_{3}+3CH_{3}CHO \\xrightarrow[\\text{Ti}{{\\text{O}}_{\\text{2}}}]{紫外线}\\rm 6CO_{2}+6H_{2}O$
"]]由图可知,臭氧降解乙醛的反应为在二氧化钛的催化下,臭氧和乙醛在紫外光照射下反应生成二氧化碳和水,反应的化学方程式为$\rm 5O_{3}+3CH_{3}CHO \xrightarrow[\text{Ti}{{\text{O}}_{\text{2}}}]{紫外线}\rm 6CO_{2}+6H_{2}O$。
化学链燃烧技术是目前能源领域研究的热点之一,用$\rm NiO$作载氧体的化学链燃烧的相关热化学方程式如下:
$\text{C}{{\text{H}}_{4}}\left( \text{g} \right)+\text{NiO}\left( \text{s} \right)=\text{CO}\left( \text{g} \right)+2{{\text{H}}_{2}}\left( \text{g} \right)+\text{Ni}\left( \text{s} \right)\qquad\Delta H=+208.6 \;\mathrm{kJ} \cdot \mathrm{mol}^{-1}$
$\text{C}{{\text{H}}_{4}}\left( \text{g} \right)+2\text{NiO}\left( \text{s} \right)=\text{C}{{\text{O}}_{2}}\left( \text{g} \right)+2{{\text{H}}_{2}}\left( \text{g} \right)+2\text{Ni}\left( \text{s} \right)\qquad\Delta H=+169.9\; \mathrm{kJ} \cdot \mathrm{mol}^{-1}$
则$\text{C}{{\text{O}}_{2}}$和$\text{C}{{\text{H}}_{4}}$反应生成$\rm CO$和${{\text{H}}_{2}}$的热化学方程式为 。
${\\rm CO_{2}(g)+CH_{4}(g)=2CO(g)+2H_{2}(g )}\\qquad\\Delta {H}\\rm =+247.3\\text{ kJ}\\cdot \\text{mo}{{\\text{l}}^{-1}}$
"]]已知:①$\text{C}{{\text{H}}_{4}}\left( \text{g} \right)+\text{NiO}\left( \text{s} \right)=\text{CO}\left( \text{g} \right)+2{{\text{H}}_{2}}\left( \text{g} \right)+\text{Ni}\left( \text{s} \right)\qquad\Delta H=+208.6 \;\mathrm{kJ} \cdot \mathrm{mol}^{-1}$;②$\text{C}{{\text{H}}_{4}}\left( \text{g} \right)+2\text{NiO}\left( \text{s} \right)=\text{C}{{\text{O}}_{2}}\left( \text{g} \right)+2{{\text{H}}_{2}}\left( \text{g} \right)+2\text{Ni}\left( \text{s} \right)\qquad\Delta H=+169.9 \;\mathrm{kJ} \cdot \mathrm{mol}^{-1}$;根据盖斯定律可知,$\rm 2\times $①$\rm -$②可得${\rm CO_{2}(g)+CH_{4}(g)=2CO(g)+2H_{2}(g )}\qquad\Delta {H}=+\text{208}\text{.6 kJ}\cdot \text{mo}{{\text{l}}^{-1}}\times {2-169}\text{.9 kJ}\cdot \text{mo}{{\text{l}}^{-1}}\rm =+247.3\text{ kJ}\cdot \text{mo}{{\text{l}}^{-1}}$。
用稀氨水喷雾捕集$\text{C}{{\text{O}}_{2}}$最终可得产品$\text{N}{{\text{H}}_{4}}\text{HC}{{\text{O}}_{3}}$。
①在捕集时,气相中有中间体$\text{N}{{\text{H}}_{2}}\text{COON}{{\text{H}}_{4}}\rm ($氨基甲酸铵$\rm )$生成。现将一定量纯净的氨基甲酸铵置于恒容密闭真空容器中,分别在不同温度下进行反应:$\text{N}{{\text{H}}_{2}}\text{COON}{{\text{H}}_{4}}\left( \text{s} \right)\rightleftharpoons 2\text{N}{{\text{H}}_{3}}\left( \text{g} \right)+\text{C}{{\text{O}}_{2}}\left( \text{g} \right)$。实验测得的有关数据如表$({{t}_{1}}\lt {{t}_{2}}\lt {{t}_{3}}\rm )$:
温度$\rm /^\circ\rm C$ 气体总浓度$\rm /(\mathrm{mol} \cdot \mathrm{L}^{-1}\rm )$ 时间$\rm /min$ | $\rm 15$ | $\rm 25$ | $\rm 35$ |
| $\rm 0$ | $\rm 0$ | $\rm 0$ | $\rm 0$ |
| ${{t}_{1}}$ | $9\times {{10}^{-3}}$ | $2.7\times {{10}^{-2}}$ | $8.1\times {{10}^{-2}}$ |
| ${{t}_{2}}$ | $3\times {{10}^{-2}}$ | $4.8\times {{10}^{-2}}$ | $9.4\times {{10}^{-2}}$ |
| ${{t}_{3}}$ | $3\times {{10}^{-2}}$ | $4.8\times {{10}^{-2}}$ | $9.4\times {{10}^{-2}}$ |
氨基甲酸铵的分解反应是 $\rm ($填“放热”或“吸热”$\rm )$反应。在$\rm 15\;\rm ^\circ\rm C$,此反应的化学平衡常数$K=$ 。
②将一定量纯净的氨基甲酸铵置于恒温恒容的真空密闭容器中,发生反应:$\text{N}{{\text{H}}_{2}}\text{COON}{{\text{H}}_{4}}\left( \text{s} \right)\rightleftharpoons 2\text{N}{{\text{H}}_{3}}\left( \text{g} \right)+\text{C}{{\text{O}}_{2}}\left( \text{g} \right)$。
Ⅰ.能判断该反应达到化学平衡状态的是 $\rm ($填标号$\rm )$。
$\rm a$.$v\left( \text{N}{{\text{H}}_{3}} \right)=2v\left( \text{C}{{\text{O}}_{2}} \right)$ $\rm b$.气体的总压强不变
$\rm c$.气体的总质量不变 $\rm d$.混合气体的平均相对分子质量不变
$\rm e$.$\text{C}{{\text{O}}_{2}}$的体积分数不变 $\rm f$.$\text{N}{{\text{H}}_{2}}\text{COON}{{\text{H}}_{4}}$的物质的量浓度恒定不变
$\rm g$.混合气体的密度不变
达到平衡状态后,如将原容器容积压缩为原来的一半,则平衡 $\rm ($填“正向”“逆向”或“不”$\rm )$移动,再次达到平衡时,$\text{C}{{\text{O}}_{2}}$的浓度与原平衡相比 $\rm ($填“增大”“减小”或“不变”$\rm )$。
Ⅱ.某实验在恒容条件下,发生上述反应,根据实验测得数据绘制图像如图。
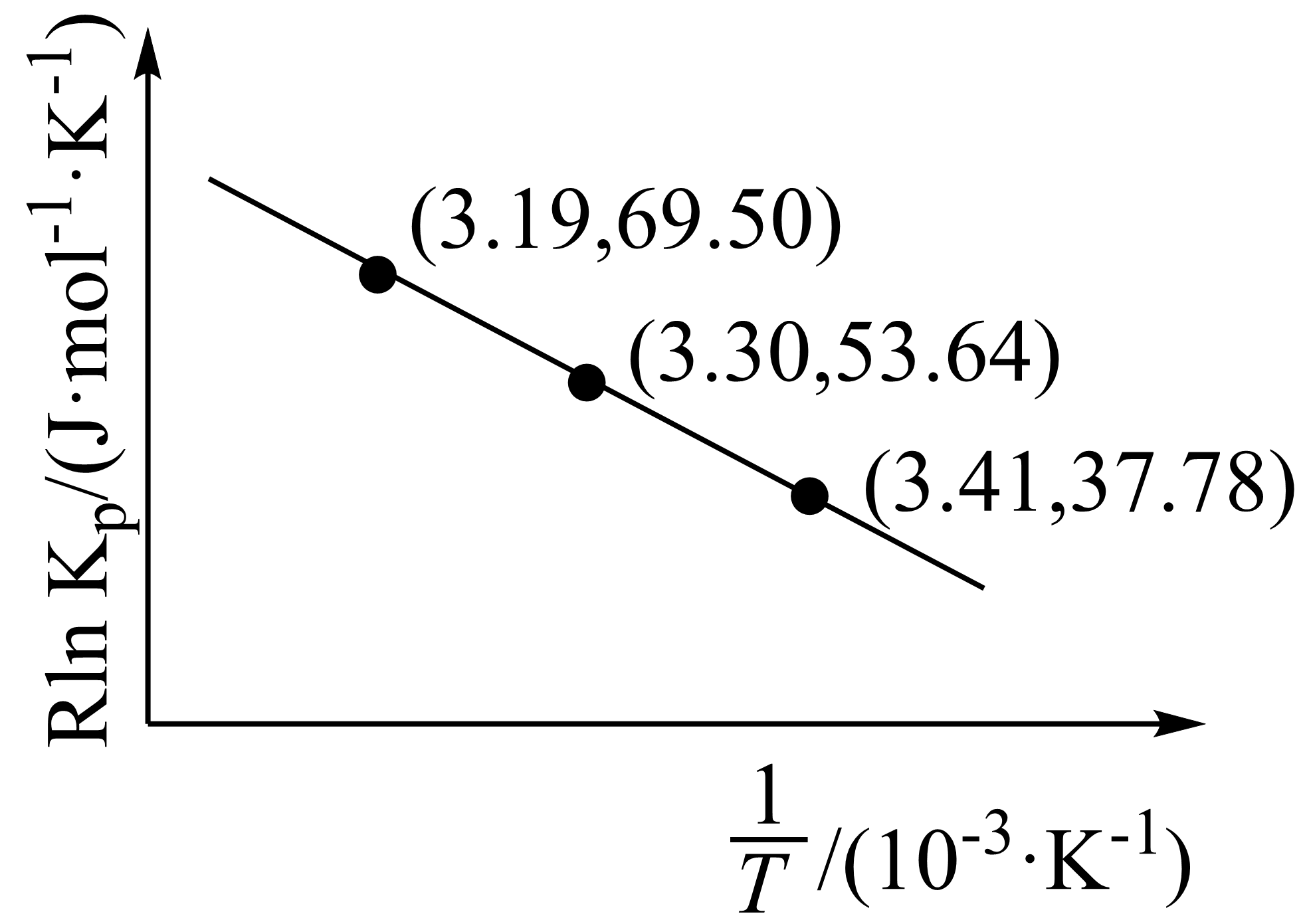
已知:$ R\ln {{ {K}}_{\text{p}}} =- \dfrac{\Delta { H}}{ {T}} +C (C$为常数,${{K}_{\text{p}}}$表示用气体平衡分压代替平衡浓度计算,分压$\rm =$总压$\rm \times $气体的物质的量分数$\rm )$。根据上图计算该反应$\Delta H=$ $\rm ($保留$\rm 2$位小数$\rm )$。
吸热;$4\\times {{10}^{-6}}$;$\\rm bcg$;逆向;不变;$ +144 .18 $
"]]①由图表可知,升高温度,气体总浓度变大,则反应正向移动,故氨基甲酸铵的分解反应是吸热反应;在$\rm 15\;\rm ^\circ\rm C$反应达到平衡时,气体总浓度为$3\times {{10}^{-2}}\;\rm mol/L$,列出“三段式”
$\begin{matrix} {} \\ 起始\left( \text{mol/L} \right) \\转化 \left( \text{mol/L} \right) \\ 平衡\left( \text{mol/L} \right) \\ \end{matrix}\begin{matrix} \text{N}{{\text{H}}_{\text{2}}}\text{COON}{{\text{H}}_{\text{4}}}\left( \text{s} \right) & \rightleftharpoons & \text{2N}{{\text{H}}_{\text{3}}}\left( \text{g} \right) & + & \text{C}{{\text{O}}_{\text{2}}}\left( \text{g} \right) \\ {} & {} & \text{0} & {} & \text{0} \\ {} & {} & {2x} & {} & {x} \\ {} & {} & {2x} & {} & {x} \\ \end{matrix}$
$2x+x=3\times {{10}^{-2}}$,$x=0.01$,此反应的化学平衡常数$ {K}={c}\left( \rm C{{O}_{2}} \right){{{c}}^{2}}\left(\rm N{{H}_{3}} \right)={{\left( 2\times {{10}^{-2}} \right)}^{2}}\times {{10}^{-2}}=4\times {{10}^{-6}}$;
②$\rm a$.$ {v}\left( \text{N}{{\text{H}}_{\text{3}}} \right) =2v \left( \text{C}{{\text{O}}_{\text{2}}} \right)$,没有体现是正反应速率还是逆反应速率,不能判断是否平衡,$\rm a$不符合题意;
$\rm b$.反应是气体分子数改变的化学反应,物质的量与压强成正比,则混合气体的压强不随时间的变化而变化,达到平衡状态,$\rm b$符合题意;
$\rm c$.反应是气体分子数改变的化学反应,反应中固体生成气体,气体的总质量不变,达到平衡状态,$\rm c$符合题意;
$\rm d$.反应为固体生成气体的反应,生成物的比例是固定的,混合气体的平均相对分子质量为定值,故不能说明反应达到平衡,$\rm d$不符合题意;
$\rm e$.反应为固体生成气体的反应,生成物的比例是固定的,$\rm CO_{2}$的体积分数不变不能说明反应达到平衡,$\rm e$不符合题意;
$\rm f$.$\rm \text{N}{{\text{H}}_{2}}\text{COON}{{\text{H}}_{4}}$为固体,没有浓度这个概念,不能说明反应达到平衡,$\rm f$不符合题意;
$\rm g$.容器体积不变,反应中生成气体总质量改变,则混合气体的密度不变说明达到平衡状态,$\rm g$符合题意;
故选:$\rm bcg$;
该反应过程中气体体积增大,如将原容器容积压缩为原来的一半,压强增大,平衡逆向移动,该反应的平衡常数$K=c\left(\rm C{{O}_{2}} \right){{c}^{2}}\left( \rm N{{H}_{3}} \right)=4{{c}^{3}}\left(\rm C{{O}_{2}} \right)$在温度不变时为定值,则再次达到平衡时,$\text{C}{{\text{O}}_{2}}$的浓度与原平衡相比不变。
由图中数据代入公式$ R\ln {{ {K}}_{\text{p}}} =- \dfrac{\Delta{H}}{ {T}} +C $可知,$69.50=-\Delta{H}\times 3.19\times {{10}^{-3}}+ {C}$,$53.64=-\Delta{H}\times 3.3\times {{10}^{-3}}+ {C}$,解得$\Delta{H=+144.18\;\rm kJ/mol}$。
高中 | 化学平衡常数题目答案及解析(完整版)
