高中 | 配合物理论 题目答案及解析
稿件来源:高途
高中 | 配合物理论题目答案及解析如下,仅供参考!
选修三
第二章 分子结构与性质
第二节 分子的立体结构
配合物理论
碲化镉$\rm (CdTe)$量子点具有优异的光电性能。某科研人员设计以电解精炼铜获得的富碲渣$\rm ($含铜、碲、银等$\rm )$为原料合成碲化镉量子点的流程如下:
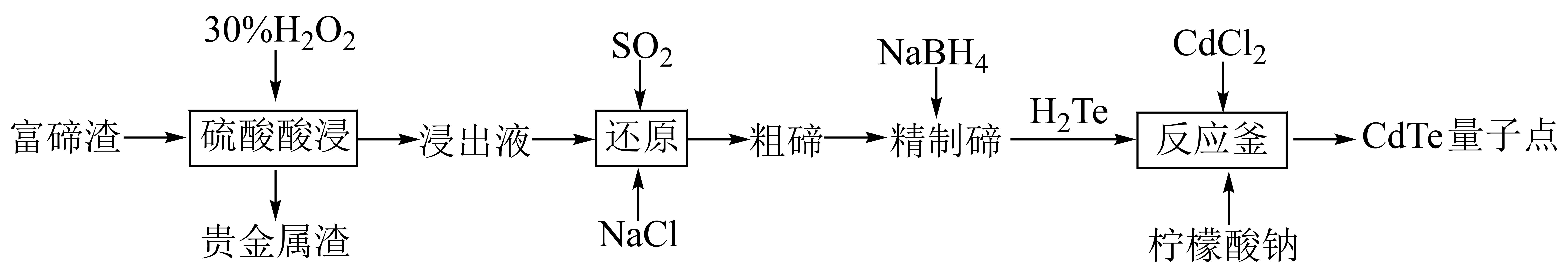
回答下列问题:
电解精炼铜时原料富碲渣将在 $\rm ($填“阴”或“阳”$\rm )$极区获得。
阳极
"]]电解精炼铜得到富碲渣,其中含贵金属,电解精炼铜时阳极产生阳极泥,含贵金属,故应在阳极区得到。
“硫酸酸浸”时,取含单质$\rm Te\ 6.38\%$的富碲渣$\rm 30\ g$,为将$\rm Te$全部溶出转化为$\rm Te{{(S{{O}_{4}})}_{2}}$需加质量分数为$\rm 30\%$的$\rm {{H}_{2}}{{O}_{2}}($密度:$\rm 1.134\ {g}/{c{{m}^{3}}}\ )$ $\rm \ mL$。但实际操作中,$\rm {{H}_{2}}{{O}_{2}}$用量远高于该计算值,原因之一是$\rm Cu$同时也被$\rm {{H}_{2}}{{O}_{2}}$浸出,请写出$\rm Cu$被浸出时发生反应的离子方程式: 。
$\\rm 3.0\\ mL$;$\\rm Cu+{{H}_{2}}{{O}_{2}}+2{{H}^{+}}=C{{u}^{2+}}+2{{H}_{2}}O$
"]]单质$\rm Te\ 6.38\%$的富碲渣$\rm 30\ g$含有纯净的$\rm Te$为$\rm 0.015\ mol$,将$\rm Te$全部溶出转化为$\rm Te{{(S{{O}_{4}})}_{2}}$,失去电子为:$\rm 0.015\ mol\times 4=0.06\ mol$;设双氧水需要$x\ \rm mol$,根据电子转移守恒,得:$x\times 2\times 1{{\rm e}^{-}}=0.06\ {\rm mol}\ {{\rm e}^{-}}$,$n\rm ({{H}_{2}}{{O}_{2}})=0.03\ mol$,则推出二者的方程式计量系数为:$\rm Te\sim2{{H}_{2}}{{O}_{2}}$,列式计算所需双氧水溶液的体积为:$\rm \dfrac{0.03\times 34}{30\%\times 1.134}\ mL\approx 3.0\ mL$。铜在酸性环境下,容易被双氧水氧化为铜离子,则$\rm Cu$被浸出时发生反应的离子方程式:$\rm Cu+{{H}_{2}}{{O}_{2}}+2{{H}^{+}}=C{{u}^{2+}}+2{{H}_{2}}O$。
化学中用标准电极电势${{E}^{\Theta }}($氧化态$\rm /$还原态$\rm )$反映微粒间得失电子能力的强弱,一般这个数值越大,氧化态转化为还原态越容易。已知硫酸酸浸液中部分微粒的标准还原电极电势为${{E}^{\Theta}}\rm (C{{u}^{2+}}/Cu)=0.337\rm \ V$、${{E}^{\Theta}}\rm (T{{e}^{4+}}/Te)=0.630\ \rm V$,则$\rm S{{O}_{2}}$“还原”酸浸液时,主要发生反应的化学方程式是 。
$\\rm 2S{{O}_{2}}+Te{{(S{{O}_{4}})}_{2}}+4{{H}_{2}}O=Te+4{{H}_{2}}S{{O}_{4}}$
"]]根据题意,标准电极电势数值越大,氧化态转化为还原态越容易,故$\rm S{{O}_{2}}$“还原”酸浸液时,主要发生反应的化学方程式是:$\rm 2S{{O}_{2}}+Te{{(S{{O}_{4}})}_{2}}+4{{H}_{2}}O=Te+4{{H}_{2}}S{{O}_{4}}$。
结合下列反应机理$\rm ($反应中水及部分产物已省略$\rm )$,推测$\rm NaCl$在“还原”步骤中的作用是 。
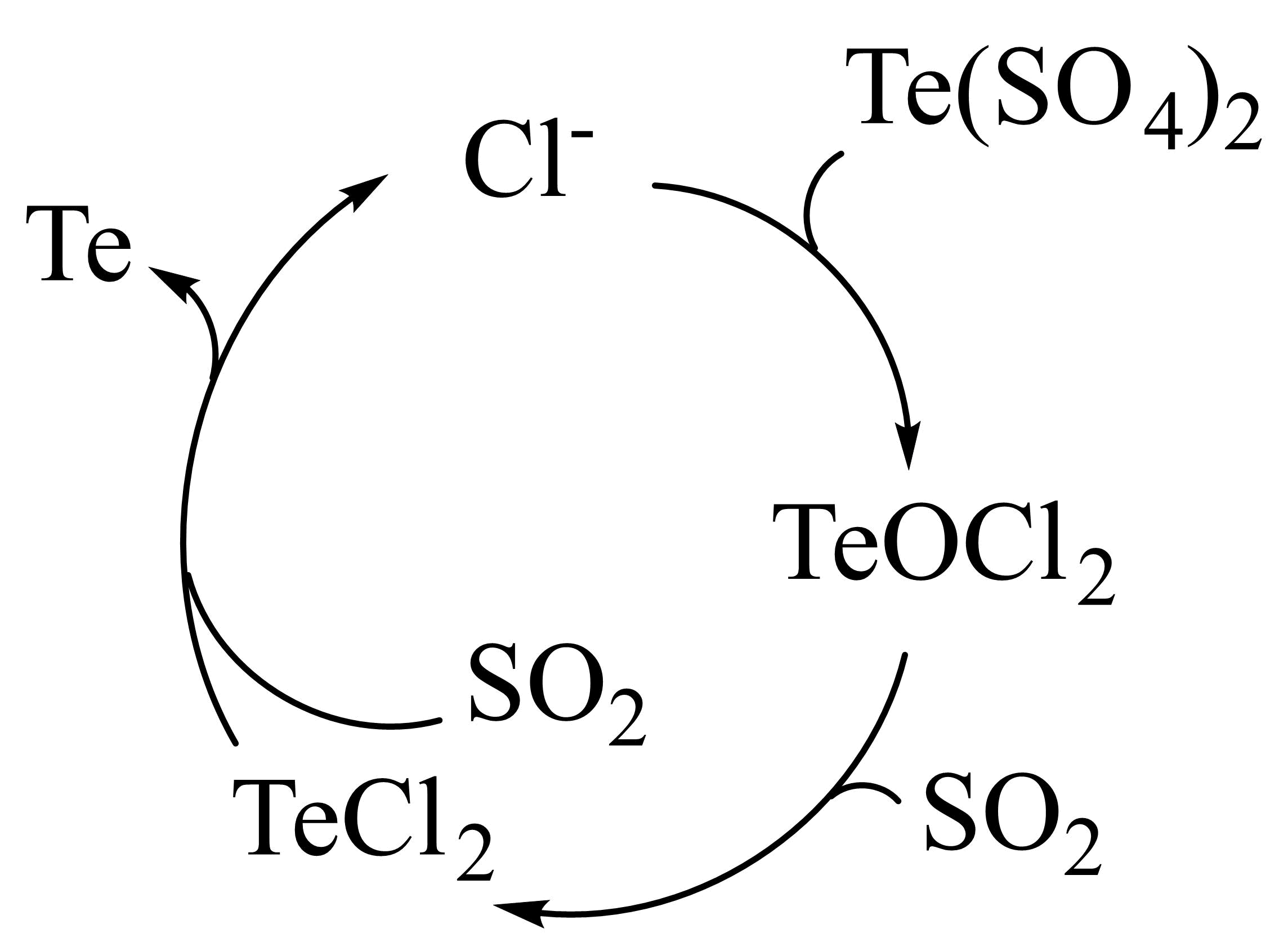
催化剂
"]]根据反应机理图,氯离子参与反应,最终又生成,推测$\rm NaCl$在“还原”步骤中的作用是作催化剂。
①合成量子点时,加入柠檬酸钠作为包覆剂,利用柠檬酸钠的憎水基团修饰$\rm CdTe$,亲水基团则用于增强其生物相容性,下列最可能替代柠檬酸钠生产具备以上特征量子点的物质是 $\rm ($填字母$\rm )$。
$\rm A$.碳酸钠
$\rm B$.甲苯
$\rm C$.乙酸乙酯
$\rm D$.硬脂酸钠
②量子点在微观尺寸发生变化时,可以在特定波长的激光照射下发出不同颜色的光,关于这一现象下列说法不正确的是 $\rm ($填字母$\rm )$。
$\rm A$.属于物理变化
$\rm B$.属于化学变化
$\rm C$.由光化学反应产生
$\rm D$.由电子跃迁形成
$\\rm D$;$\\rm BC$
"]]①根据题干信息,合成量子点时选择的包覆剂应含亲水基和憎水基,硬脂酸钠含憎水基烃基,含亲水基羧基,故选$\rm D$;甲苯和乙酸乙酯只含憎水基,碳酸钠只含亲水基,不符合题意。
②量子点在微观尺寸发生变化时,可以在特定波长的激光照射下发出不同颜色的光,这种现象是发生了电子的跃迁,属于物理变化。
胆矾的结构如图所示。下列说法不正确的是 。
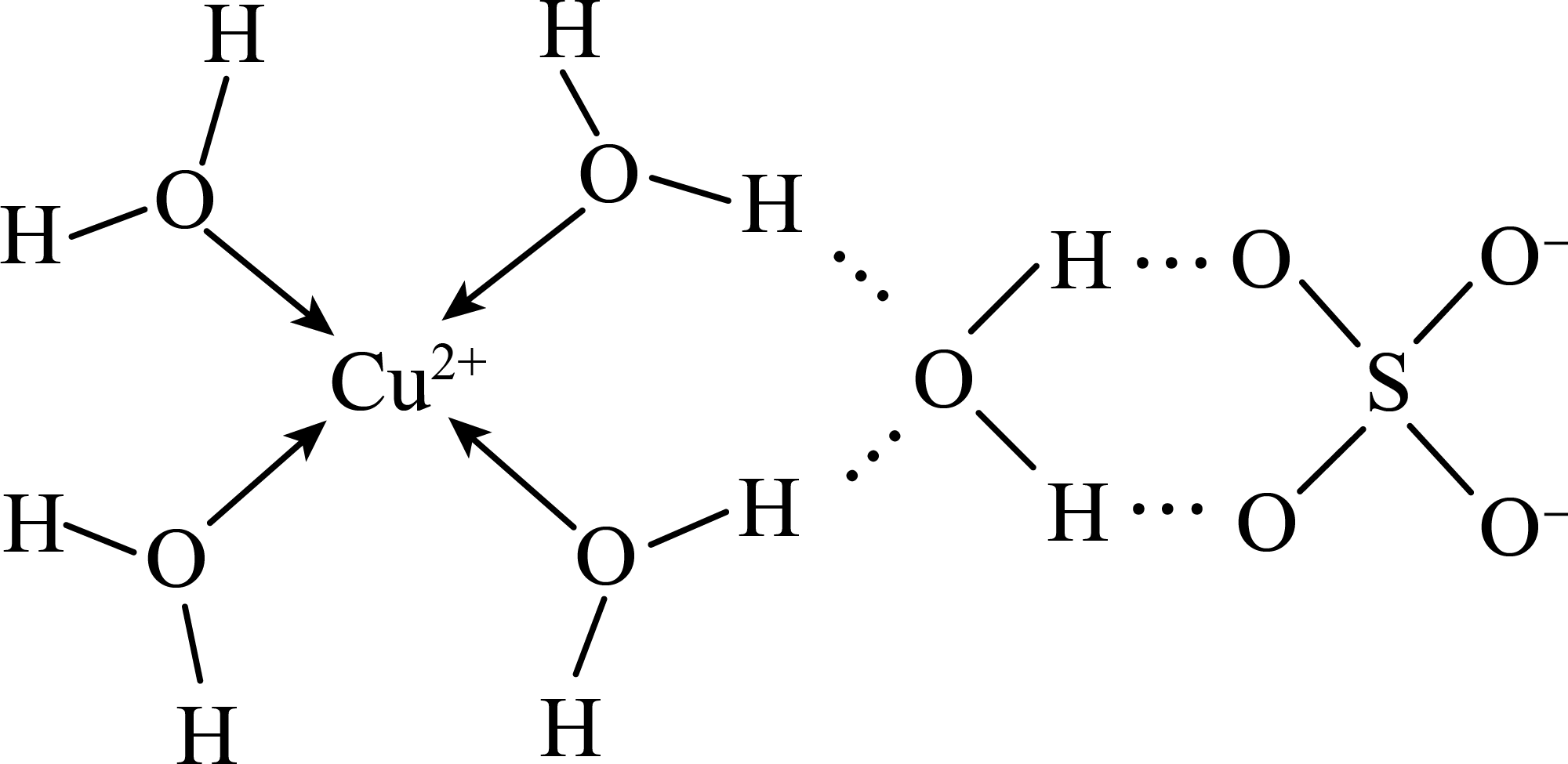
$\rm A$.胆矾晶体中含有离子键、配位键、氢键等化学键
$\rm B$.胆矾属于离子晶体
$\rm C$.$\rm SO_{4}^{2-}$的空间结构为正四面体形
$\rm D$.电负性$\rm O\gt S$,第一电离能$\rm O\lt S$
$\\rm AD$
"]]$\rm A$.胆矾晶体中含有离子键、配位键等化学键,氢键不属于化学键,故$\rm A$错误。
$\rm B$.胆矾是离子化合物,属于离子晶体,故$\rm B$正确。
$\rm C$.硫酸根离子中$\rm \operatorname{S}$的成键电子对数为$\rm 4$,孤电子对数为$\rm \dfrac{6+2-4\times 2}{2}=0$,故硫酸根的空间构型是正四面体形,故$\rm C$正确。
$\rm D$.同主族元素电负性从上到下越来越小,故电负性$\rm O\gt S$,同主族元素从上到下第一电离能越来越小,故第一电离能$\rm O\gt S$,故$\rm D$错误。
高中 | 配合物理论题目答案及解析(完整版)
