高中 | 能量最低原理 泡利原理 洪特规则 题目答案及解析
稿件来源:高途
高中 | 能量最低原理 泡利原理 洪特规则题目答案及解析如下,仅供参考!
选修三
第一章 原子结构与性质
第一节 原子结构
能量最低原理 泡利原理 洪特规则
下列说法正确的是$(\qquad)$
①电子排布为$\rm [Ar]3d^{4}4s^{2}$的中性原子是基态原子
②${\rm 1s^{2}2s^{1}2p}_{x}^{2}{\rm2p}_{y}^{2}{\rm2p}_{z}^{1}$违反了洪特规则,是激发态原子的电子排布
③![]() 不符合泡利原理
不符合泡利原理
④基态铜原子的电子排布式:$\rm 1s^{2}2s^{2}2p^{6}3s^{2}3p^{6}3d^{9}4s^{2}$
$\text{F}$的最高能级的电子云轮廓图:![]()
${{\text{O}}^{2-}}$的电子排布图:![]()
⑦$\rm Br$原子的价$\rm ($层$\rm )$电子排布式:$4{{\text{s}}^{2}}4{{\text{p}}^{5}}$
⑧$\rm 25$、$\rm 26$号元素的第二电离能$\rm 25$号的大
②$\\mathsf{}$
","","③⑦
","③⑦⑧
"]①该元素原子序数为$\rm 24$,当$\rm 3d$轨道半充满稳定,所以电子排布式应该为$\rm [Ar]3d^{5}4s^{1}$,故错误;
②${\rm 1s^{2}2s^{1}2p}_{x}^{2}{\rm2p}_{y}^{2}{\rm2p}_{z}^{1}$符合能量最低原理,是基态原子的电子排布,故错误;
③$\rm 2s$电子应该应该自旋相反,不符合泡利原理,是不存在的排布,故正确;
④不符合洪特规则;根据构造原理,基态铜原子的电子排布式应为$\rm 1s^{2}2s^{2}2p^{6}3s^{2}3p^{6}3d^{10}4s^{1}$,故错误;
⑤$\rm F$原子的核外电子排布式为$\rm 1s^{2}2s^{2}2p^{5}$,最高能级为$\rm 2p$轨道,为哑铃形,![]() 为$\rm s$轨道,故错误;
为$\rm s$轨道,故错误;
⑥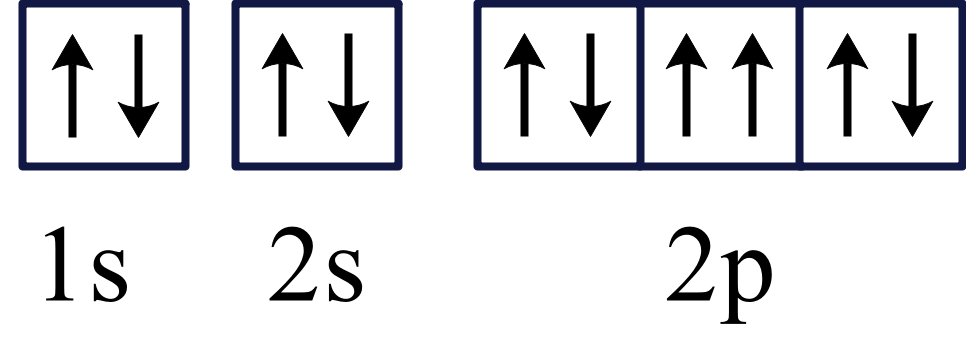 中$\rm 2p$轨道上的电子的自旋方向相同,违背泡利原理,故错误;
中$\rm 2p$轨道上的电子的自旋方向相同,违背泡利原理,故错误;
⑦$\rm Br$是$\rm 35$号元素,$\rm Br$原子的价层电子排布式:$\rm 4s^{2}4p^{5}$,故正确;
⑧$\rm 25$、$\rm 26$号元素分别为$\rm Mn$、$\rm Fe$,第二电离能$\rm Mn^{+}$转化为$\rm Mn^{2+}$时,电子排布式由$\rm 3d^{5}4s^{1}$失去$\rm 4s$上的一个电子生成较稳定的$\rm 3d^{5}$半充满状态,需要的能量较少;而$\rm Fe^{+}$到$\rm Fe^{2+}$时,由$\rm 3d^{6}4s^{1}$转变为不稳定的$\rm 3d^{6}$,需要的能量相对要多,因此$\rm 26$号元素$\rm Fe$第二电离能较大,故错误。
故选:$\rm C$
高中 | 能量最低原理 泡利原理 洪特规则题目答案及解析(完整版)
