高中 | 配合物理论 题目答案及解析
稿件来源:高途
高中 | 配合物理论题目答案及解析如下,仅供参考!
选修三
第二章 分子结构与性质
第二节 分子的立体结构
配合物理论
硼化钛$\rm (\text{Ti}{{\text{B}}_{2}}\rm )$属于六方晶系准金属化合物,强度高、硬度大,用于机械制造领域;五氟化锑$\rm (\text{Sb}{{\text{F}}_{\text{5}}}\rm )$是一种高能氟化剂,广泛应用于制药业。工业上以一种含钛的矿渣$\rm ($主要含$\text{Ti}{{\text{O}}_{2}}$、$\text{S}{{\text{b}}_{2}}{{\text{O}}_{3}}$、$\text{ZnO}$、$\text{PbO}$、$\text{NiO}$、$\text{CoO}\rm )$为原料制取硼化钛和五氟化锑的流程如图所示。
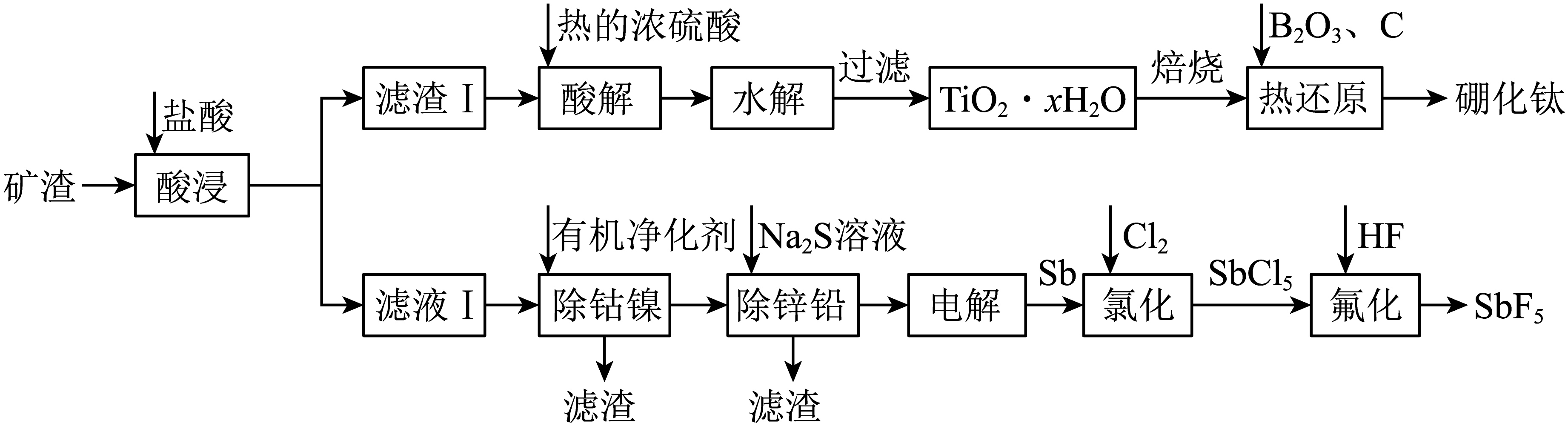
已知:①$\text{Ti}{{\text{O}}_{2}}$性质较稳定,加热时可溶于浓硫酸中形成$\text{Ti}{{\text{O}}^{2+}}$;②高温下${{\text{B}}_{2}}{{\text{O}}_{3}}$易挥发。
回答下列问题:
为了加快酸浸速率,可以采取的措施有 $\rm ($写出两条$\rm )$,滤渣Ⅰ的主要成分是 $\rm ($填化学式$\rm )$。
适当增大盐酸浓度、适当升高酸浸温度$\\rm ($或粉碎矿渣、搅拌等合理$\\rm )$;$\\text{Ti}{{\\text{O}}_{2}}$
"]]根据影响反应速率的因素,为了加快酸浸速率,可以采取的措施有适当增大盐酸浓度、适当升高酸浸温度;$\text{Ti}{{\text{O}}_{2}}$不溶于盐酸,滤渣Ⅰ的主要成分是$\text{Ti}{{\text{O}}_{2}}$。
“热还原”步骤中使用石墨化炉高温加热装置$\rm (1500\sim2100\rm\;^\circ C )$进行加热,产物中得到一种可燃性气体,此步骤主要反应的化学方程式为 ,同时测得${{\text{B}}_{2}}{{\text{O}}_{3}}$的实际用量超过理论计量值,原因是 。
$\\text{Ti}{{\\text{O}}_{2}}+{{\\text{B}}_{2}}{{\\text{O}}_{3}}+5\\text{C}\\begin{matrix} \\underline{\\underline{高温}} \\\\ {} \\\\ \\end{matrix}\\text{Ti}{{\\text{B}}_{2}}+5\\text{CO}\\uparrow $;${{\\text{B}}_{2}}{{\\text{O}}_{3}}$在高温下易挥发,反应不充分
"]]“热还原”步骤中$\text{Ti}{{\text{O}}_{2}}$、$\rm B_{2}O_{3}$、$\rm C$粉高温得到$\text{Ti}{{\text{B}}_{2}}$,产物中得到一种可燃性气体,可知该气体为$\rm CO$,此步骤主要反应的化学方程式为$\text{Ti}{{\text{O}}_{2}}+{{\text{B}}_{2}}{{\text{O}}_{3}}+5\text{C}\begin{matrix} \underline{\underline{高温}} \\ {} \\ \end{matrix}\text{Ti}{{\text{B}}_{2}}+5\text{CO}\uparrow $;根据题目信息,高温下${{\text{B}}_{2}}{{\text{O}}_{3}}$易挥发,所以${{\text{B}}_{2}}{{\text{O}}_{3}}$的实际用量超过理论计量值。
“除钴镍”步骤中,有机净化剂的基本组分为大分子立体网格结构的聚合物,其净化原理如下图所示。$\text{C}{{\text{o}}^{2+}}$、$\text{N}{{\text{i}}^{2+}}$能发生上述转化而$\text{Z}{{\text{n}}^{2+}}$不能,推测可能的原因为 。
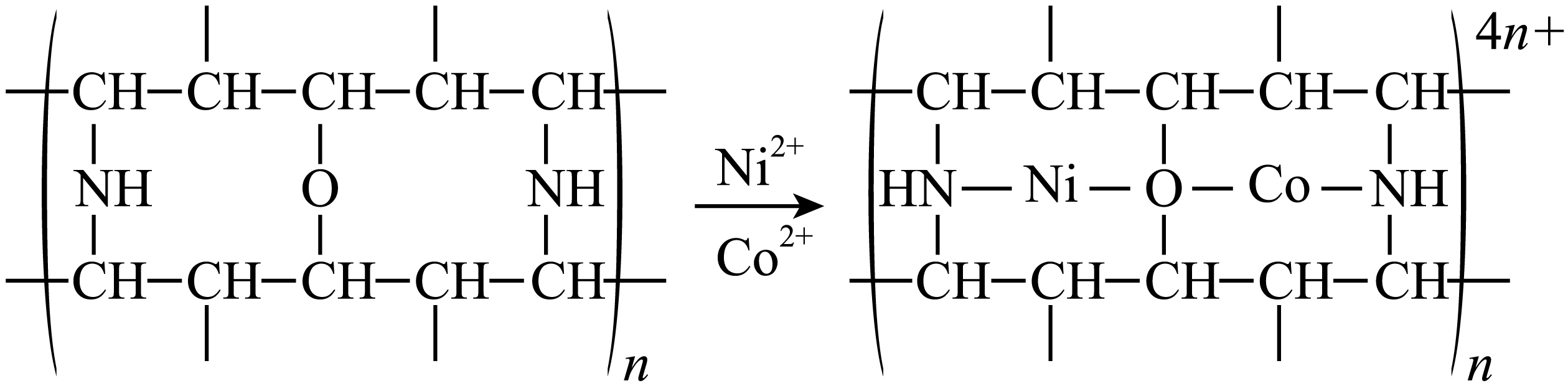
$\\text{C}{{\\text{o}}^{2+}}$、$\\text{N}{{\\text{i}}^{2+}}$半径与有机净化剂网格孔径大小匹配,可形成配位键,而$\\text{Z}{{\\text{n}}^{2+}}$不匹配
"]]根据图示,“除钴镍”步骤中,$\text{C}{{\text{o}}^{2+}}$、$\text{N}{{\text{i}}^{2+}}$半径与有机净化剂网格孔径大小匹配,可形成配位键,而$\text{Z}{{\text{n}}^{2+}}$不匹配,所以$\text{C}{{\text{o}}^{2+}}$、$\text{N}{{\text{i}}^{2+}}$能发生上述转化而$\text{Z}{{\text{n}}^{2+}}$不能。
硼化钛晶体结构及晶胞沿$z$轴的投影如下图所示,其晶胞参数$ {a}= {b}=0.303\;\rm \text{nm}$,${c}=0.323\;\rm \text{nm}$,$\alpha =\beta =90^\circ$,$\gamma =120{}^\circ $,设阿伏加德罗常数的值为${{N}_{\text{A}}}$。由图可知$\text{B}$的配位数为 ,硼化钛的密度为 $\rm \text{g}/{c}{{\text{m}}^{3}}\rm ($列出计算式即可$\rm )$。
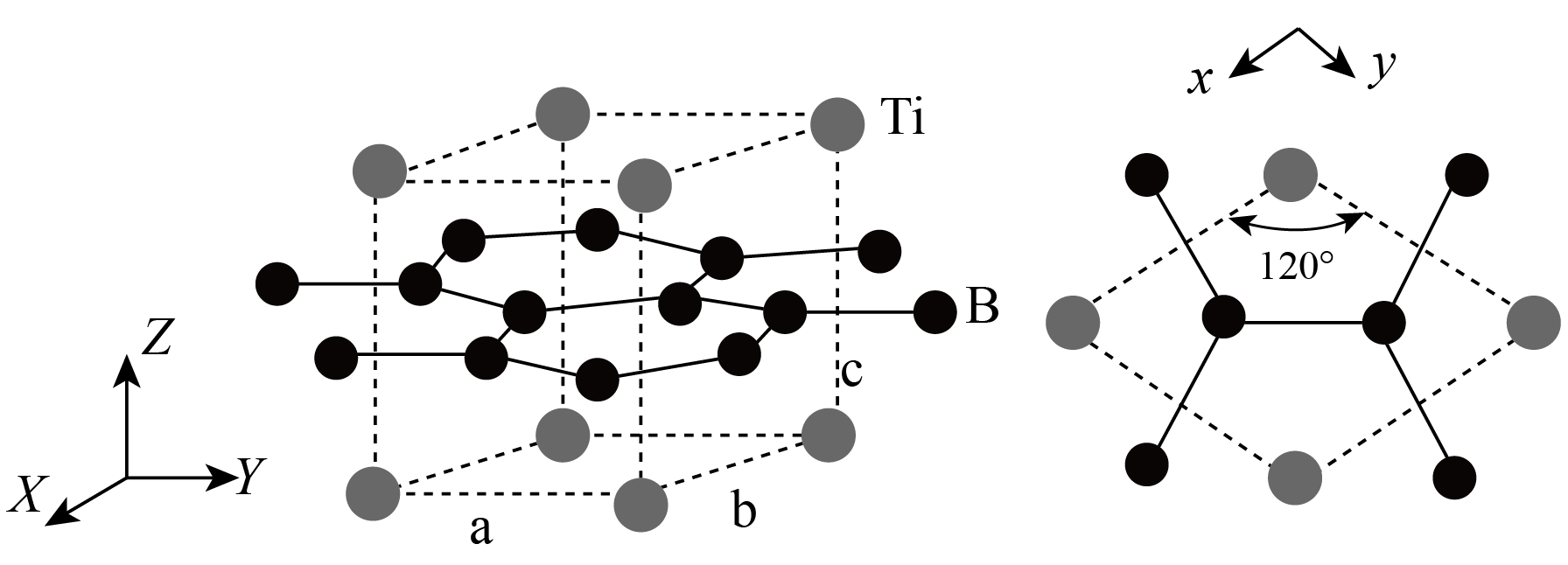
$\\rm 6$;$\\dfrac{48+2\\times 11}{{{N}_{\\text{A}}}\\times \\dfrac{\\sqrt{3}}{2}\\times {{0.303}^{2}}\\times 0.323\\times {{10}^{-21}}}$
"]]硼化钛晶体结构及晶胞沿$z$轴的投影如下图所示,其晶胞参数$ {a}= {b}=0.303\;\rm \text{nm}$,${c}=0.323\;\rm \text{nm}$,$\alpha =\beta =90^\circ$,$\gamma =120{}^\circ $,设阿伏加德罗常数的值为${{N}_{\text{A}}}$。根据图示,$\text{B}$的配位数为$\rm 6$;根据均摊原则,晶胞中$\rm Ti$原子数$\rm 1$,$\rm B$原子数为$\rm 2$,晶胞的体积为$\dfrac{\sqrt{3}}{2}\times {{0.303}^{2}}\times 0.323\times {{10}^{-21}}\;\rm {c}{{\text{m}}^{3}}$,所以硼化钛的密度为$\dfrac{48+2\times 11}{{{N}_{\text{A}}}\times \dfrac{\sqrt{3}}{2}\times {{0.303}^{2}}\times 0.323\times {{10}^{-21}}}\;\rm \text{g}/{c}{{\text{m}}^{3}}$。
高中 | 配合物理论题目答案及解析(完整版)
