高中 | 配合物理论 题目答案及解析
稿件来源:高途
高中 | 配合物理论题目答案及解析如下,仅供参考!
选修三
第二章 分子结构与性质
第二节 分子的立体结构
配合物理论
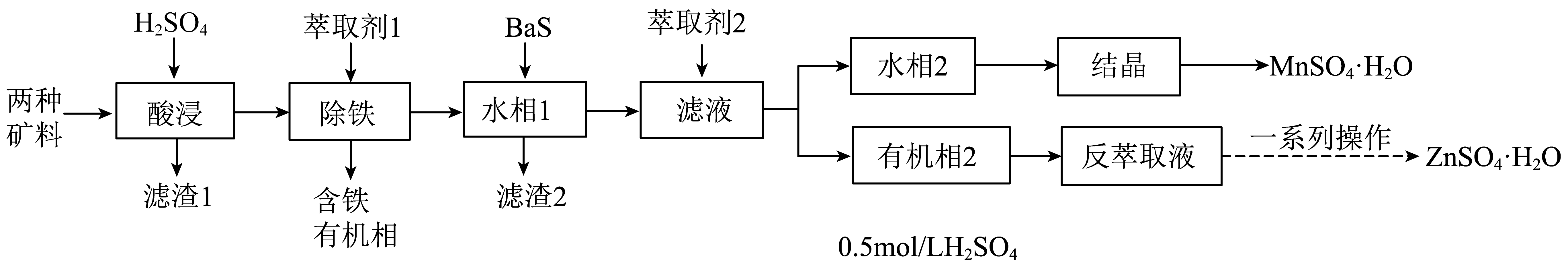
利用锌精矿$\rm (ZnS)$和软锰矿$\rm (MnO_{2})$两种矿料$\rm ($含少量杂质$\rm Fe$、$\rm Cu$、$\rm Pb$等元素的化合物及$\rm SiO_{2})$生产硫酸锌和硫酸锰的流程如下:
 已知常温下:①$\rm H_{2}S$的电离常数为:${{K}_{\text{a1}}}=1.0\text{ }\times {{10}^{-7}}$,${{K}_{\text{a2}}}=1.0\text{ }\times {{10}^{-13}}$;
已知常温下:①$\rm H_{2}S$的电离常数为:${{K}_{\text{a1}}}=1.0\text{ }\times {{10}^{-7}}$,${{K}_{\text{a2}}}=1.0\text{ }\times {{10}^{-13}}$;
②${{K}_{\text{sp}}}\left( \text{ZnS} \right)=1.0\text{ }\times {{10}^{-22}}$,${{K}_{\text{sp}}}\left( \text{MnS} \right)=1.0\text{ }\times {{10}^{-13}}$;
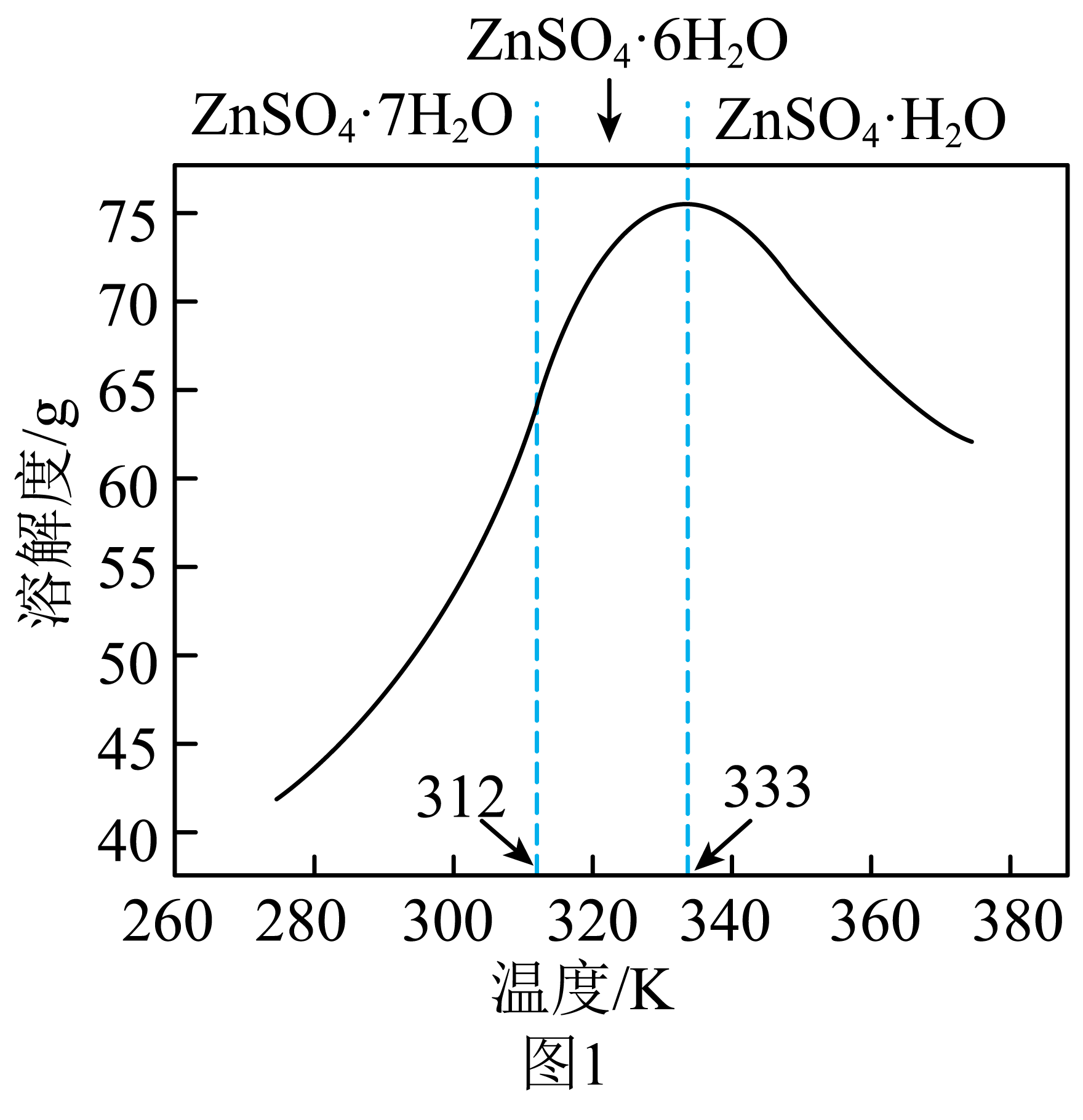
③$\rm ZnSO_{4}$的溶解度如图$\rm 1$所示:
回答下列问题:
基态$\rm S$原子占据最高能级的原子轨道形状为 。
哑铃形
"]]基态$\rm S$原子占据最高能级的原子轨道为$\rm 3p$,形状为哑铃型。
“滤渣$\rm 1$”主要成分为 和硫;写出“酸浸”过程中$\rm MnO_{2}$和$\rm ZnS$反应的化学方程式 。
$\\rm SiO_{2}$、$\\rm PbSO_{4}$ ; $\\rm ZnS+MnO_{2}+2H_{2}SO_{4}=ZnSO_{4}+MnSO_{4}+S↓+2H_{2}O$
"]]加硫酸酸浸,锌、铁、铜、锰生成硫酸盐,硫酸铅为沉淀和二氧化硅一起进入滤渣$\rm 1$;
“酸浸”过程中$\rm MnO_{2}$和$\rm ZnS$反应生成硫单质,化学方程式为:$\rm ZnS+MnO_{2}+2H_{2}SO_{4}=ZnSO_{4}+MnSO_{4}+S↓+2H_{2}O$。
“除铁”的萃取剂为磷酸二$\rm (2-$乙基己基$\rm )$酯$\rm ($用$\rm HA$表示$\rm )$,萃取后含铁的物质为$\rm [Fe(HA)_{2}(H_{2}O)_{2}]ASO_{4}$,该物质中$\rm Fe^{3+}$的配位数为 。
$\\rm 4$
"]]萃取后含铁的物质为$\rm [Fe(HA)_{2}(H_{2}O)_{2}]ASO_{4}$,该物质中$\rm Fe^{3+}$的配位数为$\rm 2+2=4$。
$\rm BaS$为可溶性钡盐。向“水相$\rm 1$”中加入适量$\rm BaS$,发生主要反应的离子方程式为 ;若溶液中$\rm S^{2-}$的浓度控制不当,会造成$\rm Zn^{2+}$、$\rm Mn^{2+}$沉淀而损失,若溶液中$\rm Zn^{2+}$、$\rm Mn^{2+}$的浓度为$\rm 0.10$ $\rm mol·L^{-1}$,则应控制溶液中$c\left( {{\text{H}}^{+}} \right)$不小于 $\rm mol·L^{-1}$。$\rm ($已知溶液中$\rm H_{2}S$的浓度为$\rm 1.0\times 10^{-3}$ $\rm mol/L)$
$\\rm Cu^{2+}+S^{2-}$ $\\rm +Ba^{2+}+\\text{SO}_{\\text{4}}^{\\text{2-}}\\rm =CuS↓+BaSO_{4}↓$ ; $\\rm 0.10$
"]]向“水相$\rm 1$”中加入适量$\rm BaS$,发生主要反应的离子方程式为:$\rm Cu^{2+}+S^{2-}$ $\rm +Ba^{2+}+\text{SO}_{\text{4}}^{\text{2-}}\rm =CuS↓+BaSO_{4}↓$。
若溶液中$\rm S^{2-}$的浓度控制不当,会造成$\rm Zn^{2+}$、$\rm Mn^{2+}$沉淀而损失,若溶液中$\rm Zn^{2+}$、$\rm Mn^{2+}$的浓度为$\rm 0.10$ $\rm mol·L^{-1}$,则应控制溶液中$c\left( {{\text{H}}^{+}} \right)$不小于$\rm 0.10$ $\rm mol·L^{-1}$。
${{K}_{\text{a1}}}{{K}_{\text{a2}}}=\dfrac{{{c}^{\text{2}}}\text{(}{{\text{H}}^{+}}\text{)}c\text{(}{{\text{S}}^{\text{2-}}}\text{)}}{c({{\text{H}}_{\text{2}}}\text{S)}}={{10}^{-20}}$,由${{K}_{\text{sp}}}\left( \text{ZnS} \right)=1.0\text{ }\times {{10}^{-22}}$,${{K}_{\text{sp}}}\left( \text{MnS} \right)=1.0\text{ }\times {{10}^{-13}}$且$\rm Zn^{2+}$、$\rm Mn^{2+}$的浓度为$\rm 0.10$ $\rm mol·L^{-1}$,可知$c\text{(}{{\text{S}}^{\text{2-}}}\text{)}\le 1.0\text{ }\times {{10}^{-23}}$,带入${{K}_{\text{a1}}}{{K}_{\text{a2}}}=\dfrac{{{c}^{\text{2}}}\text{(}{{\text{H}}^{+}}\text{)}c\text{(}{{\text{S}}^{\text{2-}}}\text{)}}{c\text{(}{{\text{H}}_{\text{2}}}\text{S)}}={{10}^{-20}}$,可得$c\left( {{\text{H}}^{+}} \right)\ge 0.10\text{ mol/L}$。
从“反萃取液”中获得$\rm ZnSO_{4}·H_{2}O$晶体的操作为:控制温度在 $\rm K$以上,蒸发至有大量固体析出、 、洗涤、干燥。
$\\rm 333$ ; 趁热过滤
"]]观察题图可知应该≥$\rm 333$ $\rm K$,并且趁热过滤。
$\rm ZnSO_{4}·H_{2}O$产品的纯度可用配位滴定法测定。下列关于滴定分析,正确的是 。
$\rm A$.滴定前,锥形瓶和滴定管均须用标准溶液润洗
$\rm B$.将标准溶液装入滴定管时,应借助漏斗转移
$\rm C$.滴定终点时,读取标准液体积时俯视滴定管液面,则测得的体积比实际消耗的小
$\rm D$.滴定前滴定管尖嘴内有气泡,滴定后尖嘴内无气泡,则测得的体积比实际消耗的大
$\\rm CD$
"]]$\rm A$.滴定前,锥形瓶不须用标准溶液润洗,$\rm A$错误;
$\rm B$.将标准溶液装入滴定管时,应借助烧杯转移,$\rm B$错误;
$\rm C$.滴定终点时,读取标准液体积时俯视滴定管液面,则测得的体积比实际消耗的小,$\rm C$正确;
$\rm D$.滴定前滴定管尖嘴内有气泡,滴定后尖嘴内无气泡,则测得的体积比实际消耗的大,$\rm D$正确;
故选:$\rm CD$。
高中 | 配合物理论题目答案及解析(完整版)
高中 | 配合物理论 题目答案及解析
稿件来源:高途
高中 | 配合物理论题目答案及解析如下,仅供参考!
选修三
第二章 分子结构与性质
第二节 分子的立体结构
配合物理论
1、利用锌精矿和软锰矿
两种矿料
含少量杂质
、
、
等元素的化合物及
生产硫酸锌和硫酸锰的流程如下:
 已知常温下:①
已知常温下:①的电离常数为:
,
;
②,
;
③的溶解度如图
所示:

回答下列问题:
1.1、基态原子占据最高能级的原子轨道形状为 。
1.2、“滤渣”主要成分为 和硫;写出“酸浸”过程中
和
反应的化学方程式 。
1.3、“除铁”的萃取剂为磷酸二乙基己基
酯
用
表示
,萃取后含铁的物质为
,该物质中
的配位数为 。
1.4、为可溶性钡盐。向“水相
”中加入适量
,发生主要反应的离子方程式为 ;若溶液中
的浓度控制不当,会造成
、
沉淀而损失,若溶液中
、
的浓度为
,则应控制溶液中
不小于
。
已知溶液中
的浓度为
1.5、从“反萃取液”中获得晶体的操作为:控制温度在
以上,蒸发至有大量固体析出、 、洗涤、干燥。
1.6、产品的纯度可用配位滴定法测定。下列关于滴定分析,正确的是 。
.滴定前,锥形瓶和滴定管均须用标准溶液润洗
.将标准溶液装入滴定管时,应借助漏斗转移
.滴定终点时,读取标准液体积时俯视滴定管液面,则测得的体积比实际消耗的小
.滴定前滴定管尖嘴内有气泡,滴定后尖嘴内无气泡,则测得的体积比实际消耗的大
高中 | 配合物理论题目答案及解析(完整版)
免责声明:
① 凡本站注明“稿件来源:高途”的所有文字、图片和音视频稿件,版权均属本网所有,任何媒体、网站或个人未经本网协议授权不得转载、链接、转贴或以其他方式复制发表。已经本站协议授权的媒体、网站,在下载使用时必须注明“稿件来源:高途”,违者本站将依法追究责任。
② 本站注明稿件来源为网络的文/图等稿件均为转载稿,本站转载出于非商业性的教育和科研之目的,并不意味着赞同其观点或证实其内容的真实性。如转载稿涉及版权等问题,请作者在两周内速来电或来函联系。
可作氨选择性催化还原法脱除的催化剂。
下列说法正确的是
二氯化硝基五氨合钴,摩尔质量:是一种难溶于乙醇的棕黄色针状晶体经常用于研究配位化合物内界的键合方式。某实验小组对其进行合成与表征,实验原理及合成步骤如下:
一种新型漂白剂结构如下图可用于漂白羊毛等,其中、、为不同周期不同主族的短周期元素,原子的核外电子排布式为,、、的最外层电子数之和等于的最外层电子数,基态原子核外有两个单电子,、对应的简单离子核外电子排布相同。
卟啉锌超分子在现代农业、科技和国防建设中有着许多独特的用途,其分子结构如图所示。下列关于卟啉锌超分子的说法正确的是
硼化钛属于六方晶系准金属化合物,强度高、硬度大,用于机械制造领域;五氟化锑是一种高能氟化剂,广泛应用于制药业。工业上以一种含钛的矿渣主要含、、、、、为原料制取硼化钛和五氟化锑的流程如图所示。




