高中 | 杂化轨道理论 题目答案及解析
稿件来源:高途
高中 | 杂化轨道理论题目答案及解析如下,仅供参考!
选修三
第二章 分子结构与性质
第二节 分子的立体结构
杂化轨道理论
卟啉锌超分子在现代农业、科技和国防建设中有着许多独特的用途,其分子结构如图所示。下列关于卟啉锌超分子的说法正确的是$(\qquad)$
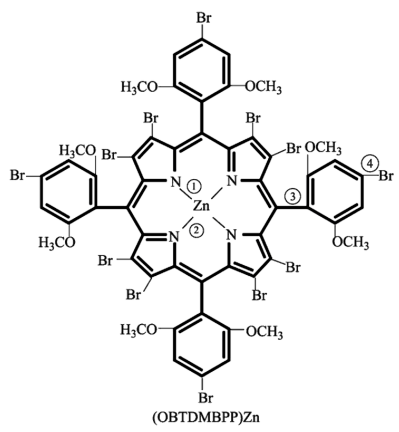
基态$\\text{Zn}$原子的核外有$\\rm 7$种不同空间运动状态的电子
","图中①②③④处的化学键属于配位键的是①②
","该超分子中的碳原子采取的杂化方式为$\\text{s}{{\\text{p}}^{2}}$、$\\text{s}{{\\text{p}}^{3}}$
","该超分子含有的第二周期元素中,第一电离能最大的是$\\rm O$元素
"]$\rm A$.$\rm Zn$是$\rm 30$号元素,基态$\rm Zn$原子核外电子排布式是$\rm 1s^{2}2s^{2}2p^{6}3s^{2}3p^{6}3d^{10}4s^{2}$,核外有$\rm 1+1+3+1+3+5+1=15$种不同空间运动状态的电子,$\rm A$错误;
$\rm B$.图中所标四处中,③、④均为共价键,①处$\rm N$原子形成$\rm 3$个键,$\rm N$原子价电子数为$\rm 5$,所以$\rm 3$个键均为极性共价键,$\rm N$原子还有一对孤电子对,②处$\rm N$原子形成$\rm 4$个键,则与$\rm Zn$原子形成的应是配位键,$\rm B$错误;
$\rm C$.苯环、含氮杂环、碳碳双键中的碳原子均为$\rm sp^{2}$杂化,甲基中的碳原子为$\rm sp^{3}$杂化,$\rm C$正确;
$\rm D$.同周期自左至右第一电离能呈增大趋势,但$\rm N$原子的$\rm 2p$轨道半满,更稳定,第一电离能大于相邻元素,所以第二周期元素中,第一电离能最大的是$\rm N$,$\rm D$错误。
故选:$\rm C$
高中 | 杂化轨道理论题目答案及解析(完整版)
