高中 | 配合物理论 题目答案及解析
稿件来源:高途
高中 | 配合物理论题目答案及解析如下,仅供参考!
选修三
第二章 分子结构与性质
第二节 分子的立体结构
配合物理论
二氯化硝基$\rm ·$五氨合钴$\rm (\left[ \text{Co}{{\left( \text{N}{{\text{H}}_{3}} \right)}_{5}}\text{N}{{\text{O}}_{2}} \right]\text{C}{{\text{l}}_{2}}$,摩尔质量:$\rm 261\;\rm g/mol)$是一种难溶于乙醇的棕黄色针状晶体经常用于研究配位化合物内界的键合方式。某实验小组对其进行合成与表征,实验原理及合成步骤如下:
【实验仪器及用品】
小烧杯、锥形瓶、量筒、表面皿、玻璃棉、胶头滴管、镊子、布氏漏斗、抽滤瓶、$\rm pH$试纸。无水乙醇、常温和冷的蒸馏水
【实验步骤】
Ⅰ.量取$\rm 15.0\;\rm mL\;\rm 2\;\rm mol/L$的氨水,倒入小烧杯中,向其中加入$\rm 2.50\;\rm g\;\left[ \text{Co}{{\left( \text{N}{{\text{H}}_{3}} \right)}_{5}}\text{Cl} \right]\text{C}{{\text{l}}_{2}}\rm ($摩尔质量:$\rm 250.5\;\rm g/mol)$,搅拌使其充分溶解,滤去不溶物;
Ⅱ.室温时,将滤液置于锥形瓶内,向其中逐滴加入$\rm 4\;\rm mol/L$盐酸,调整滤液$\rm pH$至$\rm 3\sim 4$后,升温至$\rm 65\;\rm ^\circ\rm C$,搅拌状态下加入$\rm 1.0\;\rm g\text{ NaN}{{\text{O}}_{2}}$,加热,稳定保持此温度反应$\rm 30\;\rm min$;
Ⅲ.将反应后所得溶液冷却至室温,小心加入$\rm 15.0\;\rm mL$浓盐酸后,降温使其结晶完全:
Ⅳ.将得到的固液混合物倒入布氏漏斗中进行抽滤后,经过一系列实验操作,干燥后得到棕黄色晶体$\rm 1.9\;\rm g$。
请回答下列问题:
$\left[ \text{Co}{{\left( \text{N}{{\text{H}}_{3}} \right)}_{5}}\text{N}{{\text{O}}_{2}} \right]\text{C}{{\text{l}}_{2}}$中$\rm Co$的配位数为 。
$\\rm 6$
"]]$\left[ \text{Co}{{\left( \text{N}{{\text{H}}_{3}} \right)}_{5}}\text{N}{{\text{O}}_{2}} \right]\text{C}{{\text{l}}_{2}}$中$\rm Co$的配体是$\text{N}{{\text{H}}_{\text{3}}}$、$\text{N}{{\text{O}}_{\text{2}}}$,配位数为$\rm 6$。
反应的化学方程式为 。
$\\left[ \\text{Co}{{\\left( \\text{N}{{\\text{H}}_{3}} \\right)}_{5}}\\text{Cl} \\right]\\text{C}{{\\text{l}}_{2}}+\\text{NaN}{{\\text{O}}_{2}}=\\left[ \\text{Co}{{\\left( \\text{N}{{\\text{H}}_{3}} \\right)}_{5}}\\text{N}{{\\text{O}}_{2}} \\right]\\text{C}{{\\text{l}}_{2}}+\\text{NaCl}$
"]]$\left[ \text{Co}{{\left( \text{N}{{\text{H}}_{3}} \right)}_{5}}\text{Cl} \right]\text{C}{{\text{l}}_{2}}$与$\text{NaN}{{\text{O}}_{2}}$反应生成$\left[ \text{Co}{{\left( \text{N}{{\text{H}}_{3}} \right)}_{5}}\text{N}{{\text{O}}_{2}} \right]\text{C}{{\text{l}}_{2}}$和$\text{NaCl}$。
步骤Ⅱ中,对锥形瓶中滤液采取的最佳控温方式为 。
水浴加热
"]]控温低于$\rm 100\;\rm ^\circ\rm C$且需“稳定保持”,故选:水浴加热。
步骤Ⅲ中若盐酸加入过多,会导致所得晶体内界中配体$\text{N}{{\text{H}}_{3}}$的数量 $\rm ($填“增多”或“减少”$\rm )$,产生这种现象的原因是 。
减少;盐酸加入过多,$\\text{N}{{\\text{H}}_{3}}$转变为$\\text{NH}_{4}^{+}$,失去配位能力
"]]酸性过强促进$\text{N}{{\text{H}}_{3}}$转变为$\text{NH}_{4}^{+}$,$\text{NH}_{4}^{+}$无配位能力,因此会导致配合物内界$\text{N}{{\text{H}}_{3}}$减少。
请补充最后一步抽滤后获得产品的一系列实验操作为 。
用冷的蒸馏水淋洗之后,再用无水乙醇淋洗,洗去产品表面水分
"]]将布氏漏斗中产物先水洗然后醇洗。
此实验的产率为 $\rm \%($列出计算式即可$\rm )$。
$\\left[ 1.9\\times 250.5/\\left( 2.5\\times 261 \\right) \\right]\\times 100$
"]]$\left[ \text{Co}{{\left( \text{N}{{\text{H}}_{3}} \right)}_{5}}\text{Cl} \right]\text{C}{{\text{l}}_{2}}+\text{NaN}{{\text{O}}_{2}}=\left[ \text{Co}{{\left( \text{N}{{\text{H}}_{3}} \right)}_{5}}\text{N}{{\text{O}}_{2}} \right]\text{C}{{\text{l}}_{2}}+\text{NaCl}$,$\left[ \text{Co}{{\left( \text{N}{{\text{H}}_{3}} \right)}_{5}}\text{Cl} \right]\text{C}{{\text{l}}_{2}}$物质的量为: $\dfrac{\text{2}\text{.5}}{\text{250}\text{.5}}\text{ mol}$,$\text{NaN}{{\text{O}}_{2}}$物质的量为:$\dfrac{\text{1}}{\text{69}}\text{ mol}$,前者物质的量小,所以应该按前者物质的量计算产物的理论产值$\dfrac{\text{2}\text{.5}}{\text{250}\text{.5}}\times {261\;\rm g}$,所以此实验的产率为:$\left[ 1.9\times 250.5/\left( 2.5\times 261 \right) \right]\times 100\% $。
有文献表明:进行此实验时,若温度不能稳定控制在$\rm 65\;\rm ^\circ\rm C$左右,可能会产生二氯化亚硝酸根$\rm ·$五氨合钴$\rm (\left[ \text{Co}{{\left( \text{N}{{\text{H}}_{3}} \right)}_{5}}\text{ONO} \right]\text{C}{{\text{l}}_{2}}\rm )$;
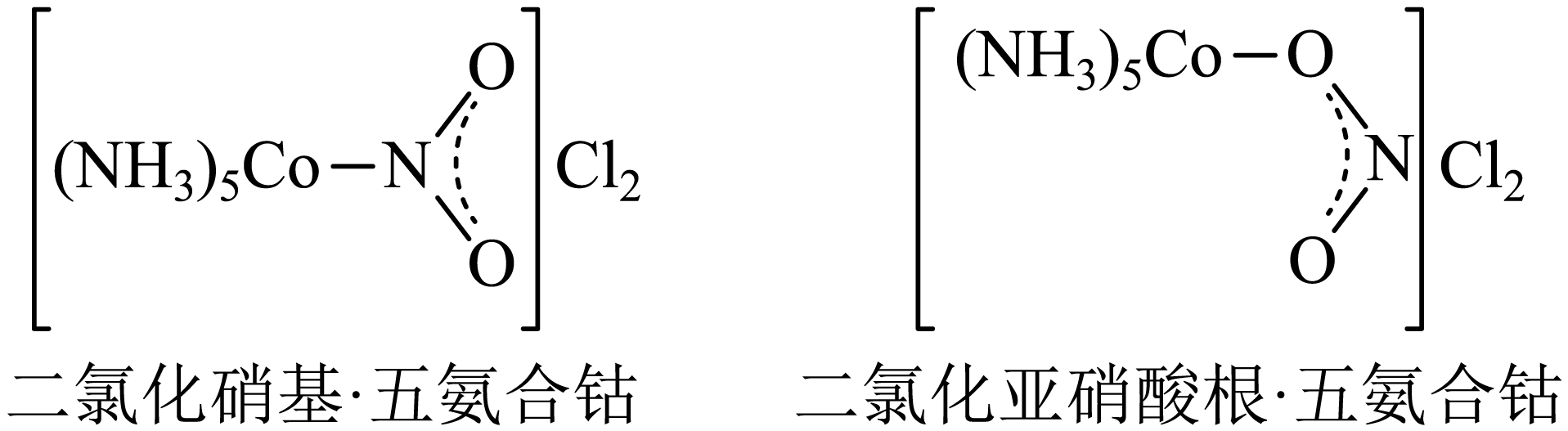
①上述两种配位化合物的关系是 $\rm ($填字母,下同$\rm )$。
$\rm a$.同素异形体 $\rm b$.同系物 $\rm c$.同分异构体 $\rm d$.同位素
②上述两种配位化合物的结构中,$\rm \text{NO}_{2}^{-}$的配位方式不同,若想对二者进行鉴别,可采用的仪器分析方法是 。
$\rm a$.原子光谱法 $\rm b$.红外光谱法 $\rm c$.核磁共振氢谱法 $\rm d$.$\rm X-$射线衍射法
$\\rm c$;$\\rm bd$
"]]①$\rm a$.同素异形体是指同一元素构成的不同单质;
$\rm b$.同系物是结构相似在分子组成上相差若干各$\rm \text{C}{{\text{H}}_{\text{2}}}$的化合物;
$\rm c$.分子式相同、结构不同的化合物之间互为同分异构体;
$\rm d$.同位素是指质子数相同中子数不同的同一元素的不同种原子;
上述两种配合物分子式相同,结构不同,互为同分异构体;
故选:$\rm c$;
②$\rm a$.原子光谱法用于元素的定量分析,$\rm a$错误;
$\rm b$.红外光谱法是分子吸收光谱的一种,不同的化学键或官能团吸收频率不同,可以对这两种物质进行鉴别,$\rm b$正确;
$\rm c$.核磁共振氢谱法用于确定分子中有几种位置的氢原子,两种物质中氢原子的位置相同,$\rm c$错误;
$\rm d$.$\rm X-$射线衍射可以了解晶胞内原子的位置、排列顺序、呈现的对称性等信息,所以可以对这两种物质进行鉴别,$\rm d$正确;
故选:$\rm bd$。
高中 | 配合物理论题目答案及解析(完整版)
